Logam alkali
| Logam alkali dalam tabel periodik | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| ↓ Periode | |||||||||||
| 2 | Litium (Li) 3 | ||||||||||
| 3 | Natrium (Na) 11 | ||||||||||
| 4 | Kalium (K) 19 | ||||||||||
| 5 | Rubidium (Rb) 37 | ||||||||||
| 6 | Sesium (Cs) 55 | ||||||||||
| 7 | Fransium (Fr) 87 | ||||||||||
|
Legenda
| |||||||||||
Logam alkali adalah unsur logam golongan 1 atau IA dari tabel periodik. Golongan ini juga dikenal sebagai golongan litium. Golongan ini terdiri dari unsur litium (Li), natrium (Na), kalium (K)[note 1], rubidium (Rb), sesium (Cs)[note 2], dan unsur radioaktif fransium (Fr). Golongan ini terletak pada blok-s tabel periodik karena seluruh logam alkali memiliki elektron terluarnya pada posisi orbital-s: konfigurasi unsur/elektron ini tercermin pada sifat karakteristik mereka. Logam-logam alkali menyajikan contoh terbaik sifat-sifat tren golongan pada tabel periodik, dengan unsur-unsur yang menunjukkan perilaku homolog yang terkarakterisasi dengan baik.
Logam-logam alkali memiliki sifat-sifat yang sangat mirip: semuanya berkilau, lunak, logam yang sangat reaktif pada suhu dan tekanan standar dan mudah kehilangan elektron terluarnya membentuk kation dengan muatan +1. Semua logam alkali mudah dipotong menggunakan pisau karena lunaknya, menampakkan kilau permukaannya yang cepat memudar di udara karena oksidasi oleh uap air dan oksigen (dan nitrogen khusus untuk lithium). Mengingat reaktivitasnya yang tinggi, mereka harus disimpan di dalam minyak untuk mencegah reaksi dengan udara, dan hanya dijumpai secara alami sebagai garam dan tidak pernah sebagai unsur bebas. Cesium, logam alkali kelima, adalah yang paling reaktif di antara semua logam. Dalam tata nama IUPAC modern, logam alkali mencakup logam-logam golongan 1,[note 3] kecuali hidrogen (H), yang dicantumkan sebagai unsur golongan 1 tetapi tidak dianggap sebagai suatu logam alkali karena perilakunya yang menyimpang jauh dari perilaku logam alkali. Semua logam alkali bereaksi dengan air. Logam alkali yang lebih berat bereaksi lebih hebat daripada yang ringan.
Seluruh logam alkali yang ditemukan berada di alam: sesuai urutan kelimpahannya, natrium adalah yang paling melimpah, diikuti oleh kalium, litium, rubidium, sesium, dan terakhir fransium, yang sangat jarang karena radioaktivitasnya yang sangat tinggi; fransium hanya terjadi dalam jumlah renik, produk rantai peluruhan alami. Telah dilakukan sejumlah eksperimen untuk mencoba mensintesis ununennium (Uue), yang merupakan anggota berikutnya dari golongan ini, tetapi mereka semua menemui kegagalan. Namun, ununennium mungkin bukan suatu logam alkali mengingat efek relativistik, yang diprediksi memiliki pengaruh besar terhadap sifat kimia unsur superberat; kalaupun ternyata Uue adalah logam alkali, diprediksi akan mempunyai perbedaan sifat fisika dan kimia dengan homolognya yang lebih ringan.
Sebagian besar logam alkali mempunyai banyak aplikasi yang berbeda. Salah satu aplikasi unsur murni yang paling terkenal adalah penggunaan rubidium dan sesium dalam jam atom, yang mana jan atom sesium lebih akurat dan presisi dalam menunjukkan waktu. Aplikasi umum senyawa natrium adalah lampu uap natrium, yang memancarkan cahaya dengan sangat efisien. Garam dapur, atau natrium klorida, telah digunakan sejak zaman dulu. Natrium dan kalium juga merupakan unsur esensial, memiliki peran biologis utama sebagai elektrolit, dan meskipun logam alkali lainnya tidak esensial, mereka juga mempunyai pengaruh beragam terhadap tubuh, baik menguntungkan maupun merugikan.
Sifat-sifat
[sunting | sunting sumber]Fisika dan kimia
[sunting | sunting sumber]Sifat fisika dan kimia logam alkali dapat dengan mudah dijelaskan berdasarkan konfigurasi elektron valensi yang mereka miliki ns1, yang menghasilkan ikatan logam yang lemah. Oleh karena itu, seluruh logam alkali lunak dan memiliki densitas,[5] titik leleh[5] dan didih rendah,[5] begitu pula dengan kalor sublimasi, penguapan, dan disosiasi[6] Seluruh logam alkali mengkristal dengan struktur kristal body-centered cubic,[6] dan memiliki warna nyala yang khas karena elektron terluarnya sangat mudah tereksitasi.[6] Konfigurasi ns1 juga mengakibatkan logam alkali memiliki jari-jari atom dan ion yang sangat besar, serta konduktivitas termal dan listrik yang tinggi.[6] Sifat kimia mereka didominasi oleh hilangnya elektron valensi sunyi untuk membentuk tingkat oksidasi +1, mengingat mudahnya mengionkan elektron ini serta tingginya energi ionisasi kedua.[6] Sifat kimia lima teratas anggota logam alkali sebagian besar telah teramati. Kimiawi fransium belum begitu mapan mengingat radioaktivitasnya yang ekstrem;[5] sehingga, presentasi sifat-sifatnya dalam artikel ini terbatas. Sedikit yang diketahui tentang francium menunjukkan bahwa perilakunya sangat dekat dengan cesium, seperti yang diperkirakan. Sifat fisik francium bahkan lebih samar karena unsur massalnya tidak pernah diamati; maka setiap data yang mungkin ditemukan dalam literatur tentu saja merupakan ekstrapolasi spekulatif.[7]
| Nama | Litium | Natrium | Kalium | Rubidium | Sesium | Fransium |
|---|---|---|---|---|---|---|
| Nomor atom | 3 | 11 | 19 | 37 | 55 | 87 |
| Massa atom standar (u)[note 4][10][11] | 6,94(1)[note 5] | 22,98976928(2) | 39,0983(1) | 85,4678(3) | 132,9054519(2) | [223][note 6] |
| Konfigurasi elektron | [He] 2s1 | [Ne] 3s1 | [Ar] 4s1 | [Kr] 5s1 | [Xe] 6s1 | [Rn] 7s1 |
| Titik leleh | 453,69 K 180,54 °C 356,97 °F |
370,87 K 97,72 °C 207,9 °F |
336,53 K, 63,38 °C, 146,08 °F |
312,467 K, 39,31 °C, 102,76 °F |
301,59 K, 28,44 °C, 83,19 °F |
? 300 K, ? 27 °C, ? 80 °F[note 7] |
| Titik didih | 1615 K, 1342 °C, 2448 °F |
1156 K, 883 °C, 1621 °F |
1032 K, 759 °C, 1398 °F |
961 K, 688 °C, 1270 °F |
944 K, 671 °C, 1240 °F |
? 950 K, ? 677 °C, ? 1250 °F[13][note 7] |
| Massa jenis (g·cm−3) | 0,534 | 0,968 | 0,89 | 1,532 | 1,93 | ? 1,87 |
| Kalor fusi (kJ·mol−1) | 3,00 | 2,60 | 2,321 | 2,19 | 2,09 | ? 2 |
| Kalor penguapan (kJ·mol−1) | 136 | 97,42 | 79,1 | 69 | 66,1 | ? 65 |
| Kalor pembentukan monatomik gas (kJ·mol−1) | 162 | 108 | 89,6 | 82,0 | 78,2 | ? |
| Tahanan listrik at 298 K (nΩ·cm) | 94,7 | 48,8 | 73,9 | 131 | 208 | ? |
| Jari-jari atom (pm) | 152 | 186 | 227 | 248 | 265 | ? |
| Jari-jari ion M+ ion (pm)[note 8] | 76 | 102 | 138 | 152 | 167 | ? 180 |
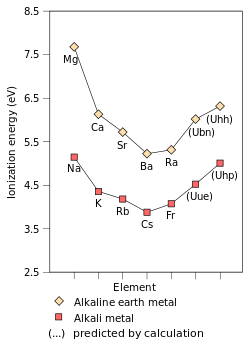
| Energi ionisasi pertama (kJ·mol−1) | 520,2 | 495,8 | 418,8 | 403,0 | 375,7 | 392,8[14] |
| Afinitas elektron (kJ·mol−1) | 59,62 | 52,87 | 48,38 | 46,89 | 45,51 | ? 47,2[15] |
| Entalpi disosiasi of M2 (kJ·mol−1) | 106,5 | 73,6 | 57,3 | 45,6 | 44,77 | ? 42,1[16] |
| Elektronegativitas Pauling | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | ? 0,7[note 9] |
| Potensial elektrode standar (E°(M+→M0); V) | −3,0405 | −2,714 | −2,925 | −2,925 | −2,923 | ? |
| Warna uji nyala Emisi utama/panjang gelombang absorpsi (nm) |
Merah krimson 670,8 |
Kuning 589,2 |
Ungu 766,5 |
Merah-ungu 780,0 |
Biru 455,5 |
? Merah |
Logam-logam alkali lebih menunjukkan kemiripan di antara mereka dibandingkan dengan golongan-golongan lain.[5] Misalnya, dari atas ke bawah menunjukkan kenaikan jari-jari atom,[19] penurunan elektronegativitas,[19] kenaikan reaktivitas,[5] dan penurunan titik leleh dan titik didih[19] begitu juga dengan kalor fusi dan kalor penguapan.[6] Secara umum, densitas meningkat sepanjang kolom tabel dari atas ke bawah, dengan perkecualian densitas kalium lebih kecil daripada natrium.[19] Salah satu dari sangat sedikit sifat logam alkali yang tidak menampilkan tren yang mulus adalah potensial reduksi: nilai litium adalah anomali, menjadi lebih negatif daripada yang lain.[6] Hal ini karena ion Li+ memiliki energi hidrasi yang sangat tinggi dalam fase gas: meskipun ion litium mengganggu struktur air secara signifikan, menyebabkan perubahan entropi lebih tinggi, energi hidrasi yang tinggi ini cukup untuk membuat potensial reduksi menunjukkan litium sebagai logam alkali yang paling elektropositif, meskipun kesulitan mengalami ionisasi dalam fase gas.[6]
Seluruh logam alkali stabil berwarna perak kecuali sesium, yang memiliki warna emas:[20] ia adalah salah satu dari tiga logam yang berwarna keemasan (dua lainnya adalah tembaga dan emas).[6] Selain itu, logam alkali tanah berat kalsium, stronsium, dan barium, serta lantanida divalen, begitu pula europium dan iterbium, berwarna kuning pucat, meskipun warnanya jauh lebih menonjol daripada sesium.[6] Kilaunya cepat memudar di udara akibat oksidasi.[5] Kesemuanya membentuk kristal dengan struktur body-centered cubic,[6] dan mempunyai warna nyala yang berbeda karena elektron s terluarnya sangat mudah tereksitasi.[6]
Seluruh logam alkali sangat reaktif dan tidak pernah dijumpai dalam bentuk unsur di alam.[21] Oleh sebab itu, mereka biasanya disimpan dalam minyak mineral atau kerosen (minyak parafin).[22] Mereka bereaksi agresif dengan halogen untuk membentuk halida logam alkali, berupa senyawa kristal ionik putih yang seluruhnya larut dalam air kecuali litium fluorida (LiF).[5] Logam alkali juga bereaksi dengan air untuk membentuk alkali hidroksida kuat dan oleh karenanya harus ditangani dengan kehati-hatian ekstra. Logam alkali yang lebih berat bereaksi lebih hebat daripada yang lebih ringan; sebagai contoh, ketika diteteskan ke dalam air, sesium menghasilkan ledakan yang lebih besar daripada kalium.[5][23][24] Logam alkali memiliki energi ionisasi pertama yang paling rendah pada masing-masing periodenya pada tabel periodik[7] karena muatan nuklir efektif mereka yang rendah[5] dan kemampuan membentuk konfigurasi gas mulia dengan menghilangkan satu elektron saja. Energi ionisasi kedua seluruh logam alkali sangat tinggi[5][7] karena berada dalam kondisi kulit elektron yang terisi penuh dan juga lebih dekat pada inti atom;[5] oleh karena itu, mereka hampir selalu kehilangan sebuah elektron, membentuk kation.[6] Alkalida adalah perkecualian: mereka adalah senyawa tak stabil yang mengandung logam alkali pada tingkat oksidasi −1, yang sangat tidak biasa sebelum penemuan alkalida, logam alkali tidak diperkirakan dapat membentuk anion dan diduga hanya dapat berada sebagai garam sebagai kation saja. Anion alkalida telah mengisi orbital-subkulit-s, yang memberikan stabilitas lebih dan memungkinkan keberadaannya. Seluruh logam alkali stabil kecuali litium diketahui dapat membentuk alkalida,[25][26][27] dan teori alkalida menjadi jauh lebih menarik karena stoikiometrinya dan potensial ionisasi yang rendah adalah sesuatu yang luar biasa. Alkalida secara kimia mirip dengan elektrida, yaitu garam dengan elektron terperangkap bertindak sebagai anion.[28] Contoh alkalida yang sangat menyolok adalah "natrium hidrida terbalik", H+Na− (kedua ion membentuk kompleks), yang bertentangan dengan natrium hidrida biasa, Na+H−:[29] senyawa ini tidak stabil dalam isolasi, mengingat energi tinggi yang dihasilkan dari perpindahan dua elektron dari hidrogen ke natrium, meskipun beberapa turunannya diperkirakan metastabil atau stabil.[29][30]
Dalam larutan akuatik, ion logam alkali membentuk ion akua dengan rumus [M(H2O)n]+, dengan adalah bilangan solvasi. Bilangan koordinasi dan bentuk mereka sesuai dengan hasil yang diharapkan berdasarkan jari-jari ion mereka. Dalam larutan akuatik, molekul air yang langsung melekat pada ion logam dikatakan milik bidang koordinasi pertama, juga dikenal sebagai kulit solvasi pertama atau primer. Ikatan antara molekul air dan ion logam adalah ikatan kovalen datif, dengan atom oksigen menyumbangkan kedua elektron untuk membentuk ikatan. Setiap molekul air yang terkoordinasi dapat diikat dengan molekul air lainnya melalui ikatan hidrogen. Posisi yang disebut terakhir dikatakan berada dalam bidang koordinasi kedua. Namun, untuk kation logam alkali, bidang koordinasi kedua tidak didefinisikan dengan baik karena muatan +1 pada kation tidak cukup tinggi untuk mempolarisasi molekul air pada kulit solvasi utama, tetapi cukup bagi mereka untuk membentuk ikatan hidrogen yang kuat dengan bidang koordinasi kedua, menghasilkan entitas yang lebih stabil.[31][32] Bilangan solvasi Li+ telah ditentukan secara eksperimen yaitu 4, membentuk [Li(H2O)4]+ tetrahedral: sementara bilangan solvasi 3 atau 6 telah dijumpai untuk ion aqua litium, bilangan solvasi yang kurang dari 4 dapat menghasilkan pembentukan pasangan ion, dan bilangan solvasi yang lebih tinggi dapat diinterpretasikan sebagai molekul air yang mendekati [Li(H2O)4]+ melalui permukaan tetrahedron, meskipun simulasi dinamika molekul dapat menunjukkan adanya ion heksaaqua oktahedral. Ada juga mungkin enam molekul air dalam bidang solvasi primer ion natrium, membentuk ion [Na(H2O)6]+ oktahedral.[8][32] Sementara itu diduga sebelumnya bahwa logam alkali yang lebih berat juga membentuk ion heksaaqua oktahedral, karena saat itu telah ditemukan bahwa kalium dan rubidium mungkin membentuk ion [K(H2O)8]+ dan [Rb(H2O)8]+, yang memiliki struktur antiprismatik persegi, dan bahwa sesium membentuk ion [Cs(H2O)12]+ dengan 12 koordinasi.[33]
Litium
[sunting | sunting sumber]Kimia litium menunjukkan beberapa perbedaan dari golongan logam alkali lainnya karena kation Li+ yang kecil mempolarisasi anion dan menghasilkan senyawa yang lebih memiliki karakter kovalen.[5] Litium dan magnesium memiliki hubungan diagonal karena kemiripan jari-jari atom mereka,[5] sehingga keduanya menunjukkan kemiripan. Sebagai contoh, litium membentuk nitrida stabil, suatu sifat yang umum di antara logam alkali tanah (golongan magnesium) tetapi unik untuk logam alkali.[34] Sebagai tambahan, dalam golongan masing-masing, hanya litium dan magnesium yang membentuk senyawa organologam kovalen (misalnya LiMe dan MgMe2).[35]
Litium fluorida adalah satu-satunya halida logam alkali yang tidak larut dalam air,[5] dan litium hidroksida adalah satu-satunya hidroksida logam alkali yang tidak higroskopis.[5] Sebaliknya, litium perklorat dan garam litium lainnya dengan anion besar yang tidak dapat dipolarisasi jauh lebih stabil daripada senyawa logam alkali analogi lainnya, kemungkinan karena Li+ memiliki energi solvasi yang tinggi.[6] Efek ini juga berarti bahwa garam litium yang paling sederhana umumnya berada dalam bentuk terhidrasi, karena bentuk anhidratnya sangat higroskopis: hal ini memungkinkan garam-garam seperti litium klorida dan litium bromida digunakan dalam pengawalembab (bahasa Inggris: dehumidifier) dan penyejuk udara.[6]
Fransium
[sunting | sunting sumber]Fransium juga diprediksi menunjukkan beberapa perbedaan karena massa atomnya yang tinggi, menyebabkan elektron bergerak pada fraksi hampir mendekati kecepatan cahaya dan dengan demikian efek relativistik menjadi lebih menonjol. Berlawanan dengan kecenderungan penurunan elektronegativitas dan energi ionisasi logam alkali, elektronegativitas dan energi ionisasi fransium diprediksi lebih tinggi daripada sesium mengingat stabilisasi relativistik elektron 7s nya; selain itu, jari-jari atomnya diperkirakan pendek yang tidak sewajarnya.[14][36][37] Seluruh sifat fisika fransium yang diketahui juga menyimpang dari kecenderungan yang jelas dari litium ke sesium, seperti energi ionisasi pertama, afinitas elektron, dan kemampuan mempolarisasi anion.[37] Molekul CsFr juga terpolarisasi sebagai Cs+Fr−, menunjukkan bahwa efek relativistik jauh lebih kuat dalam mempengaruhi subkulit 7s fransium daripada subkulit 6s sesium.[37] Sebagai tambahan, fransium superoksida (FrO2) diperkirakan memiliki karakter kovalen, tidak seperti superoksida logam alkali lainnya, karena kontribusi ikatan dari elektron 6p fransium.[37]
Inti atom
[sunting | sunting sumber]| Z |
Logam alkali |
Stabil |
Meluruh |
tidak stabil: cetak miring isotop ganjil–ganjil diberi warna pink
| ||
|---|---|---|---|---|---|---|
| 3 | litium | 2 | — | Li | Li | |
| 11 | natrium | 1 | — | Na | ||
| 19 | kalium | 2 | 1 | K | K | K |
| 37 | rubidium | 1 | 1 | Rb | Rb | |
| 55 | sesium | 1 | — | Cs | ||
| 87 | fransium | — | — | Tidak ada isotop primordial (Fr adalah radioisotop renik) | ||
| Radioaktif: 40K, t1/2 1,25 × 109 tahun; 87Rb, t1/2 4,9 × 1010 tahun; 223Fr, t1/2 22,0 menit | ||||||
Seluruh logam alkali memiliki nomor atom ganjil; oleh karena itu, isotopnya haruslah ganjil–ganjil (nomor proton dan neutron keduanya ganjil) atau ganjil–genap (nomor proton ganjil, nomor neutron genap). Inti atom ganjil–ganjil memiliki nomor massa genap, sementara inti atom ganjil–genap memiliki nomor massa ganjil. Nuklida primordial ganjil–ganjil jarang dijumpai karena sebagian besar inti atom ganjil–ganjil sangat tak stabil sehingga cenderung mengalami peluruhan beta, karena produk peluruhannya adalah genap–genap, dan oleh karena itu ikatannya lebih kuat, mengingat efek pasangan nuklir.[38]
Mengingat langkanya inti atom ganjil–ganjil, hampir semua isotop primordial logam alkali adalah ganjil–genap (kecuali isotop litium-6 yang stabil dan ringan, dan radioisotop kalium-40 yang berumur panjang). Untuk nomor massa ganjil, hanya ada satu nuklida beta-stabil tunggal, karena tidak ada perbedaan energi ikatan antara genap–ganjil dan ganjil–genap jika dibandingkan dengan genap–genap dan ganjil–ganjil, meninggalkan nuklida lainnya dengan nomor massa yang sama (isobar) bebas mengalami peluruhan beta menjadi nuklida dengan massa paling rendah. Efek dari ketidakstabilan bilangan ganjil kedua jenis nukleon tersebut adalah bahwa unsur bernomor ganjil, seperti logam alkali, cenderung memiliki lebih sedikit isotop stabil daripada unsur bernomor genap. Dari 26 unsur monoisotop yang hanya memiliki isotop stabil tunggal, semua kecuali satu memiliki nomor atom ganjil dan semua kecuali satu juga memiliki jumlah neutron genap. Berilium adalah pengecualian tunggal untuk kedua aturan, karena nomor atomnya yang rendah.[38]
Semua logam alkali kecuali litium dan sesium memiliki setidaknya satu radioisotop alami: natrium-22 dan natrium-24 adalah radioisotop renik yang dihasilkan secara kosmogenik,[39] kalium-40 dan rubidium-87 memiliki waktu paruh yang sangat panjang dan dengan demikian terjadi secara alami,[40] sementara seluruh isotop fransium adalah radioaktif.[40] Sesium juga dianggap radioaktif di awal abad 20,[41][42] meskipun tidak memiliki radioisotop alami.[40] (Fransium belum ditemukan pada saat itu.) Radioisotop alami kalium, kalium-40, membentuk sekitar 0,012% dari kalium alami,[43] sehingga kalium alami bersifat radioaktif lemah. Radioaktivitas alam ini menjadi dasar klaim yang keliru dari penemuan unsur 87 (logam alkali berikutnya setelah sesium) pada tahun 1925.[44][45]
Sesium-137, dengan waktu paruh 30,17 tahun, adalah satu dari dua produk fisi umur menengah utama, bersama dengan stronsium-90, yang bertanggung jawab terhadap sebagian besar radioaktivitas bahan bakar nuklir bekas setelah beberapa tahun pendinginan, sampai dengan beberapa ratus tahun setelah digunakan. Ia mengandung sebagian besar radioaktivitas yang masih tertinggal dari kecelakaan Chernobyl. 137Cs mengalami peluruhan beta berenergi tinggi dan sering kali menjadi barium-137 yang stabil. Ini merupakan pemancar radiasi gamma yang kuat. 137Cs memiliki laju penangkapan neutron yang paling lambat dan tidak dapat dibuang begitu saja, tetapi harus dibiarkan meluruh.[46] 137Cs telah digunakan sebagai pelacak dalam studi hidrologi, analog dengan penggunaan tritium.[47] Sejumlah kecil sesium-134 dan sesium-137 dilepas ke lingkungan dari hasil hampir seluruh pengujian senjata nuklir dan beberapa kecelakaan nuklir, yang paling terkenal adalah kecelakaan Goiânia dan bencana Chernobyl. Per 2005, sesium-137 adalah sumber utama radiasi pada zona alienasi di sekitar pembangkit listrik tenaga nuklir Chernobyl.[48]
Tren periodik
[sunting | sunting sumber]Logam-logam alkali lebih mirip satu sama lain dibandingkan unsur-unsur dalam satu golongan yang lain.[5] Misalnya, dari atas ke bawah pada tabel, seluruh logam alkali yang diketahui menunjukkan kenaikan jari-jari atom,[19] penurunan elektronegativitas,[19] kenaikan reaktivitas,[5] dan penurunan titik didih dan leleh[19] beserta kalor pembentukan dan penguapan.[6] Secara umum, densitas mereka meningkat sepanjang kolom dari atas ke bawah, dengan perkecualian bahwa kalium memiliki densitas yang lebih kecil daripada natrium.[19]
Jari-jari atom dan ion
[sunting | sunting sumber]
Jari-jari atom logam alkali bertambah dalam satu golongan dari atas ke bawah.[19] Karena efek perlindungan, ketika atom memiliki lebih dari satu kulit elektron, masing-masing elektron terpengaruh gaya tolak dari elektron lain seperti gaya tarik dari inti atom.[49] Pada logam alkali, elektron terluar hanya merasakan muatan bersih +1, karena beberapa muatan inti (yang sama dengan nomor atom) dinetralkan oleh elektron-elektron bagian dalam; jumlah elektron dalam logam alkali selalu kurang satu daripada muatan inti. Oleh karena itu, satu-satunya faktor yang mempengaruhi jari-jari atom logam alkali adalah jumlah kulit elektron. Oleh karena jumlah ini meningkat dari atas ke bawah sepanjang golongan, maka dari atas ke bawah dalam golongan logam alkali jari-jari atom meningkat.[19]
Jari-jari ion logam alkali jauh lebih kecil daripada jari-jari atomnya. Hal ini karena elektron terluar logam alkali berada pada kulit elektron yang berbeda dengan elektron dalamnya, sehingga ketika satu elektron tersebut dilepaskan, atom yang dihasilkan mempunyai lebih sedikit kulit elektron sehingga lebih kecil. Selain itu, muatan inti efektif telah meningkat, sehingga elektron tertarik lebih kuat kepada inti atom, akibatnya jari-jari ion menurun.[5]
Energi ionisasi pertama
[sunting | sunting sumber]
Energi ionisasi pertama suatu unsur atau molekul adalah energi yang diperlukan untuk menggerakkan elektron dengan ikatan paling longgar dari satu mol atom gas unsur atau molekul untuk membentuk satu mol ion gas dengan muatan +1. Faktor-faktor yang mempengaruhi energi ionisasi petama adalah muatan inti, jumlah penopengan oleh elektron dalam dan jarak elektron terlonggar dari inti atom, yang biasanya merupakan elektron terluar dalam unsur golongan utama. Dua faktor pertama mengubah muatan inti efektif yang dirasakan oleh elektron terlonggar. Oleh karena elektron terluar logam alkali selalu merasakan muatan inti efektif yang sama (+1), satu-satunya faktor yang mempengaruhi energi ionisasi pertama adalah jarak dari elektron terluar ke inti atom. Oleh karena jarak meningkat sepanjang golongan dari atas ke bawah, elektron terluar merasakan daya tarik yang berkurang dari inti atom sehingga energi ionisasi pertama menurun.[19] (Tren ini dipatahkan pada fransium karena stabilisasi dan kontraksi relativistik orbital 7s, sehingga elektron valensi fransium lebih dekat kepada inti daripada perkiraan menggunakan kalkulasi non-relativistik. Hal ini membuat elektron terluar fransium merasakan daya tarik inti atom yang lebih besar, sehingga sedikit menaikkan energi ionisasi pertama di atas sesium.)[36]
Energi ionisasi kedua pada logam alkali jauh lebih tinggi daripada energi ionisasi pertamanya, karena elektron terlonggar kedua adalah bagian dari kulit elektron yang terisi penuh sehingga sulit untuk dibebaskan.[5]
Reaktivitas
[sunting | sunting sumber]Reaktivitas logam alkali meningkat sepanjang golongan dari atas ke bawah. Hal ini dihasilkan oleh kombinasi dua faktor: energi ionisasi pertama dan energi atomisasi logam alkali. Oleh karena energi ionisasi pertama logam alkali menurun seiring dengan peningkatan nomor atom, hal ini menjadikan elektron terluar lebih mudah dilepaskan dari atom dan berperan dalam reaksi kimia, sehingga kereaktivan meningkat sepanjang golongan dari atas ke bawah.
Energi atomisasi menentukan kekuatan ikatan logam suatu unsur, yang melemah sepanjang golongan dari atas ke bawah seiring dengan kenaikan jari-jari atom, sehingga ikatan logam semakin panjang. Hal ini membuat delokalisasi elektron semakin menjauh dari gaya tarik inti pada logam alkali yang lebih berat. Penambahan energi atomisasi dan energi ionisasi pertama menghasilkan jumlah yang berkaitan erat dengan (tetapi tidak sama dengan) energi aktivasi reaksi logam alkali dengan zat lain. Jumlah ini menurun sepanjang golongan dari atas ke bawah, begitu pula dengan energi aktivasinya; sehingga reaksi kimia dapat terjadi lebih cepat dan reaktivitas meningkat sepanjang golongan dari atas ke bawah.[50]
Elektronegativitas
[sunting | sunting sumber]
Elektronegativitas adalah suatu sifat kimia yang menjabarkan kecenderungan sebuah atom atau gugus fungsional dalam menarik elektron (atau kerapatan elektron) dalam atom/gugus fungsi itu sendiri.[51] Jika ikatan antara natrium dan klor dalam natrium klorida adalah kovalen, pasangan elektron bersama akan tertarik kepada klor karena muatan inti efektif pada elektron terluar adalah +7 pada klor tetapi hanya +1 pasa natrium. Pasangan elektron tertarik sangat dekat ke atom klor sehingga mereka praktis berpindah ke atom klor (membentuk ikatan ion). Namun, jika atom natrium diganti dengan atom litium, elektron tidak tertarik sangat dekat ke atom klor seperti sebelumnya karena atom litium lebih kecil, yang membuat pasangan elektron tertarik lebih kuat kepada muatan inti efektif dari litium. Oleh karena itu, atom logam alkali yang lebih besar (bagian bawah golongan) menjadi kurang elektronegatif karena ikatan pasangan elektron kurang kuat.[19]
Oleh karena elektronegatifitas litium lebih tinggi, beberapa senyawanya lebih memiliki karakter kovalen. Contohnya, litium iodida (LiI) akan larut dalam pelarut organik, suatu sifat yang dimiliki oleh sebagian besar senyawa kovalen.[19] Litium fluorida (LiF) adalah satu-satunya alkali halida yang tidak larut dalam air,[5] dan litium hidroksida (LiOH) adalah satu-satunya hidroksida logam alkali yang tidak higroskopis.[5]
Titik leleh dan titik didih
[sunting | sunting sumber]Titik leleh suatu zat adalah titik ketika terjadi perubahan keadaan dari padat menjadi cairan, sementara titik didih suatu zat (dalam keadaan cair) adalah titik ketika tekanan uap cairan sama dengan tekanan lingkungan di sekeliling cairan[52][53] dan seluruh cairan berubah fasa menjadi gas. Ketika suatu logam dipanaskan hingga titik lelehnya, ikatan logam yang menjaga agar atom-atom tetap di tempatnya menjadi melemah, sehingga atom-atom dapat bergerak bebas. Ikatan logam putus total saat mencapai titik didihnya.[19][54] Oleh karena itu, penurunan titik leleh dan didih logam alkali mengindikasikan penurunan kekuatan ikatan logam sepanjang golongan dari atas ke bawah.[19] Hal ini karena atom logam saling berikatan melalui gata tarik elektromagnetik dari ion positif dengan elektron yang terdelokalisasi.[19][54] Seiring dengan kenaikan ukuran atom dari atas ke bawah dalam satu golongan (karena jari-jari atomnya meningkat), inti ion bergerak lebih jauh dari elektron terdelokalisasi, sehingga ikatan logam melemah dan logam menjadi lebih mudah meleleh dan mendidih. Inilah sebabnya titik leleh dan didih menjadi lebih rendah.[19] (Kenaikan muatan inti bukan faktor yang relevan karena efek perlindungan.)[19]
Massa jenis
[sunting | sunting sumber]Seluruh logam alkali memiliki struktur kristal yang sama (body-centered cubic),[6] dan oleh karena itu satu-satunya faktor yang relevan adalah jumlah atom yang dapat mengisi dalam volume tertentu dan massa satu atom, karena massa jenis didefinisikan sebagai massa per satuan volume. Faktor pertama bergantung pada volume atom dan jari-jari atom, yang semakin ke bawah meningkat dalam satu golongan; oleh karena itu, volume atom logam alkali meningkat dari atas ke bawah dalam golongan ini. Massa suatu atom logam alkali juga meningkat dari atas ke bawah dalam satu golongan. Oleh karena itu, tren massa jenis logam alkali bergantung pada massa atom dan jari-jari atomnya; jika nilai kedua faktor ini diketahui, rasio antar massa jenis logam alkali dapat dihitung. Hasilnya adalah bahwa massa jenis logam alkali naik dari atas ke bawah dalam golongan yang sama, dengan perkecualian pada kalium. Oleh karena seluruh unsurnya memiliki massa atom yang paling ringan dan jari-jari atom paling besar dalam periode masing-masing, logam alkali adalah logam paling kurang padat dalam tabel periodik.[19] Litium, natrium, dan kalium adalah tiga logam dalam tabel periodik yang memiliki massa jenis lebih kecil daripada air:[5] kenyataannya, litium adalah padatan paling rendah massa jenisnya pada temperatur kamar.[6]
Senyawa
[sunting | sunting sumber]Logam alkali membentuk serangkaian senyawa lengkap dengan semua anion yang biasa ditemui, yang menggambarkan tren kelompok dengan baik. Senyawa ini dapat digambarkan sebagai keterlibatan logam alkali yang menyumbangkan elektron kepada spesies akseptor dan membentuk ion monopositif.[6] Deskripsi ini paling akurat untuk alkali halida dan menjadi semakin kurang akurat seiring dengan kenaikan muatan kationik dan anionik, dan karena anion menjadi lebih besar dan lebih terpolarisasi. Misalnya, ikatan ion memberi jalan menuju ikatan logam sepanjang seri NaCl, Na2O, Na2S, Na3P, Na3As, Na3Sb, Na3Bi, Na.[6]
Hidroksida
[sunting | sunting sumber]
Seluruh logam alkali bereaksi hebat (kadang disertai ledakan) dengan air dingin, menghasilkan larutan akuatik basa kuat hidroksida logam alkali dan menghasilkan gas hidrogen.[50] Reaksi ini semakin hebat dengan kenaikan nomor atom dalam satu golongan: litium bereaksi konstan disertai penggolakan (bahasa Inggris: effervescence), tetapi natrium dan kalium dapat menyala, sedangkan rubidium dan caesium tenggelam dalam air dan menghasilkan gas hidrogen dengan sangat cepat yang dapat menimbulkan gelombang kejut dalam air sehingga dapat memecahkan wadah kaca.[5] Ledakan dihasilkan ketika suatu logam alkali dijatuhkan ke dalam air, yang sejatinya merupakan dua tahapan terpisah. Pertama, logam bereaksi dengan air, memecahkan ikatan hidrogen dalam air dan menghasilkan gas hidrogen; proses ini berlangsung lebih cepat untuk logam alkali yang lebih berat. Kedua, panas yang dihasilkan dari reaksi pertama sering kali menyalakan gas hidrogen, menyebabkan udara sekitarnya tersambar ledakan. Ledakan gas hidrogen sekunder ini yang menghasilkan nyala api yang terlihat di atas permukaan air dalam mangkuk, danau, atau badan air lainnya, dan bukan reaksi awal antara logam dengan air (yang cenderung terjadi di dalam air).[23] Hidroksida logam alkali adalah hidroksida paling basa yang paling dikenal.[6]
Penelitian terkini menyimpulkan bahwa sifat eksplosif logam alkali dalam air lebih didorong oleh ledakan Coulomb daripada semata-mata pembentukan hidrogen secara cepat.[55] Seluruh logam alkali meleleh sebagai bagian dari reaksi dengan air. Molekul-molekul air mengionisasi permukaan logam logam cair, meninggalkan permukaan logam yang bermuatan positif dan memberi muatan negatif ion air. Daya tarik menarik antara logam bermuatan dan ion air akan meningkat dengan cepat ke permukaan, menyebabkan peningkatan ionisasi secara eksponensial. Ketika gaya repulsif antara permukaan logam cair melebihi gaya tegangan permukaan, ia meledak dengan hebat.
Senyawa intermetalik
[sunting | sunting sumber]
Logam alkali membentuk banyak senyawa intermetalik satu sama lain dan dengan unsur-unsur dari golongan 2 sampai 13 dalam tabel periodik dengan berbagai stoikiometri,[6] seperti amalgam natrium dengan raksa, termasuk Na dan Na.[56] Beberapa di antaranya memiliki karakteristik ionik: membentuk paduan dengan emas, logam yang paling elektronegatif, sebagai contoh, NaAu dan KAu adalah logam, tapi RbAu dan CsAu adalah semikonduktor.[6] NaK adalah paduan natrium dan kalium yang sangat berguna karena berbentuk cair pada suhu kamar, meskipun tindakan pencegahan harus dilakukan karena reaktivitasnya yang ekstrem terhadap air dan udara. Campuran eutaktik meleleh pada suhu −12.6 °C.[57] Paduan dari 41% cesium, 47% natrium, dan 12% kalium memiliki titik leleh terendah dari logam atau paduan yang diketahui, yaitu −78 °C.[58]
Senyawa dengan unsur golongan 13
[sunting | sunting sumber]Senyawa intermetalik dari logam alkali dengan unsur berat golongan 13 (aluminium, galium, indium, dan thallium), seperti NaTl, adalah konduktor atau semikonduktor yang buruk, tidak seperti paduan normal dengan unsur-unsur sebelumnya, yang menyiratkan bahwa logam alkali telah kehilangan elektron ke anion Zintl yang terlibat.[59] Meskipun demikian, sementara unsur-unsur dalam golongan 14 dan seterusnya cenderung membentuk gugus anion diskrit, unsur golongan 13 cenderung membentuk ion polimer dengan kation logam alkali yang terletak di antara kisi ion raksasa. Sebagai contoh, NaTl terdiri dari anion polimer (—Tl−—)n dengan struktur kubik intan kovalen dengan ion Na+ berada di antara kisi anion. Logam alkali yang lebih besar tidak cocok dengan kisi anion dan cenderung memaksa unsut golongan 13 yang lebih berat untuk membentuk gugus anion.[60]
Boron adalah kasus khusus, sebagai satu-satunya nonlogam dalam golongan 13. Borida logam alkali cenderung kaya boron, dengan melibatkan ikatan boron–boron yang cukup besar yang membentuk struktur deltahedral,[6] dan secara termal tidak stabil karena logam alkali memiliki tekanan uap yang sangat tinggi pada suhu tinggi. Hal ini membuat masalah pada sintesis langsung, karena logam alkali tidak bereaksi dengan boron di bawah 700 °C, dan karenanya ini harus dilakukan dalam wadah tertutup dengan logam alkali berlebih. Selanjutnya, sebagai perkecualian dalam golongan ini, reaktivitas dengan boron menurun dalam golongan ini dari atas ke bawah: litium bereaksi sepenuhnya pada 700 °C, tetapi natrium pada suhu 900 °C dan kalium baru bereaksi mulai 1200 °C; dan reaksinya spontan untuk litium namun memerlukan waktu berjam-jam untuk kalium. Rubidium dan cesium borida bahkan belum diketahui karakteristiknya. Telah diketahui berbagai fase, seperti LiB10, NaB6, NaB15, dan KB6.[61][62] Pada tekanan tinggi, ikatan boron-boron dalam litium borida berubah dari mengikuti peraturan Wade menjadi membentuk anion Zintl seperti golongan 13 lainnya.[63]
Senyawa dengan unsur golongan 14
[sunting | sunting sumber]
|

| |
Penampakan senyawa interkalasi grafit KC8 dari samping (kiri) dan atas (kanan)
| ||
Litium dan natrium bereaksi dengan karbon membentuk asetilida, Li2C2 dan Na2C2, yang dapat pula diperoleh dari reaksi antara logam dengan asetilena. Kalium, rubidium, dan sesium bereaksi dengan grafit; atom-atom mereka terinterkalasi di antara lapisan-lapisan grafit heksagonal, membentuk senyawa interkalasi grafit dengan rumus kimia MC60 (berwarna abu-abu gelap, hampir hitam), MC48 (abu-abu gelap, hampir hitam), MC36 (biru), MC24 (biru baja), dan MC8 (perunggu) (M = K, Rb, or Cs). Senyawa-senyawa ini memiliki daya hantar listrik 200 kali lebih baik daripada grafit murni, diperkirakan karena elektron valensi logam alkali dipindahkan ke lapisan grafit (misalnya: M).[8] Pada pemanasan KC8, terjadi eliminasi atom-atom kalium sehingga menghasilkan berturut-turut KC24, KC36, KC48 dan terakhir KC60. KC8 merupakan reduktor yang sangat kuat dan bersifat piroporik serta meledak ketika terkena air.[64][65] Ketika logam alkali yang besar (K, Rb, dan Cs) pada awalnya membentuk MC8, logam alkali yang lebih kecil membentuk MC6.[66]
Ketika logam alkali bereaksi dengan unsur-unsur yang lebih berat dalam golongan karbon, terbentuk senyawa ionik dengan struktur mirip sangkar, seperti silisida M4Si4 (M = K, Rb, atau Cs), yang mengandung M+ dan ion Si tetrahedral.[8] Kimia germanida logam alkali, yang melibatkan ion germanida ion Ge4- dan cluster (Zintl) lainnya seperti Ge, Ge, Ge, dan [(Ge''";, sebagian besar analog dengan silisida yang sesuai.[6] Stanida logam alkali sebagian besar bersifat ionik, kadang-kadang dengan ion stanida (Sn4-),[60] dan kadang-kadang dengan ion Zintl yang lebih kompleks seperti Sn, yang muncul pada tetrakalium nonastanida (K).[67] Ion plumbida monatomik (Pb4-) tidak diketahui, dan memang formasinya diprediksi akan sangat tidak menguntungkan dari sisi energi; plumbida logam alkali memiliki ion Zintl yang kompleks, seperti Pb.[6]
Nitrida dan pniktida
[sunting | sunting sumber]
Lithium, logam alkali yang paling ringan, adalah satu-satunya logam alkali yang bereaksi dengan nitrogen pada kondisi standar, dan nitridanya adalah satu-satunya nitrida logam alkali yang stabil. Nitrogen adalah gas yang tidak reaktif karena memutus ikatan rangkap tiga yang kuat dalam molekul dinitrogen (N2) membutuhkan banyak energi. Pembentukan nitrida logam alkali memerlukan energi ionisasi dari logam alkali (membentuk ion M+), energi tersebut dibutuhkan untuk memutus ikatan rangkap tiga pada N2 dan membentuk ion N3−, dan semua energi yang dilepaskan dari pembentukan nitrida logam alkali berasal dari energi kisi nitrida logam alkali. Energi kisi dimaksimalkan dengan ion kecil bermuatan tinggi; logam alkali tidak membentuk ion bermuatan tinggi, hanya membentuk ion dengan muatan +1, jadi hanya lithium, logam alkali terkecil, yang bisa melepaskan cukup energi kisi untuk membuat reaksi eksotermik dengan nitrogen, membentuk lithium nitrida. Reaksi logam alkali lainnya dengan nitrogen tidak akan melepaskan cukup energi kisi dan dengan demikian akan menjadi endotermik, sehingga tidak membentuk nitrida pada kondisi standar.[34] (Natrium nitrida (Na3N) dan kalium nitrida (K3N), jika ada, sangat tidak stabil, cenderung terdekomposisi balik ke unsur penyusunnya, dan tidak dapat diproduksi dengan mereaksikan unsur-unsurnya satu sama lain pada kondisi standar.)[69][70]
Semua logam alkali mudah bereaksi dengan fosfor dan arsen untuk membentuk fosfida dan arsenida dengan rumus M3Pn (dengan M mewakili logam alkali dan Pn mewakili pniktogen). Hal ini disebabkan oleh ukuran ion P3− dan As3− yang lebih besar, sehingga energi kisi yang harus dilepaskan agar terbentuk garam tidak mencukupi.[8] Ini bukan satu-satunya fosfida dan arsenida logam alkali: misalnya, kalium diketahui memiliki sembilan fosfida, dengan rumus K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11, KP10.3, dan KP15.[71] Sementara sebagian besar logam membentuk arsenida, hanya logam alkali dan alkali tanah yang sebagian besar membentuk ion arsenida. Struktur Na3As adalah kompleks dengan jarak Na–Na yang luar biasa pendek antara 328-330 pm yang lebih pendek daripada dalam logam natrium, dan ini menunjukkan bahwa bahkan dengan logam elektropositif ini ikatannya tidak mutlak ionik.[6] Arsenida logam alkali lainnya yang tidak sesuai dengan rumus M3As telah pula diketahui, seperti LiAs, yang memiliki kilau metalik dan konduktivitas listrik yang menunjukkan adanya beberapa ikatan logam.[6] Antimonida tidak stabil dan reaktif karena ion Sb3− adalah reduktor kuat; reaksi mereka dengan asam membentuk gas beracun dan tidak stabil, stibina (SbH3).[72] Bismuthida bahkan tidak sepenuhnya ionik; mereka adalah senyawa intermetalik yang mengandung sebagian ikatan logam dan sebagian ionik.[73]
Oksida dan kalkogenida
[sunting | sunting sumber]
|

| |
Cluster Rb, terdiri dari dua oktahedra biasa yang saling terhubung satu sama lain oleh satu muka
|
Cluster Cs, terdiri dari tiga oktahedra biasa di mana masing-masing oktahedron terhubung ke keduanya dengan masing-masing satu muka. Ketiga oktahedra memiliki satu kesamaan.
|
Oksida
[sunting | sunting sumber]Semua logam alkali bereaksi hebat dengan oksigen pada kondisi standar. Mereka membentuk berbagai jenis oksida, seperti oksida sederhana (mengandung ion O), peroksida (mengandung ion O, di mana ada ikatan tunggal antara dua atom oksigen), superoksida (mengandung ion O), dan banyak lagi. Lithium terbakar di udara untuk membentuk lithium oksida, tetapi natrium bereaksi dengan oksigen untuk membentuk campuran natrium oksida dan natrium peroksida. Kalium membentuk campuran kalium peroksida dan kalium superoksida, sedangkan rubidium dan cesium hanya membentuk superoksida. Reaktivitas mereka meningkat sepanjang golongan dari atas ke bawah: sementara lithium, sodium dan potassium hanya menyala di udara, rubidium dan cesium bersifat piroforik (terbakar spontan di udara).[34]
Logam alkali yang lebih kecil cenderung memolarisasi anion yang lebih kompleks (peroksida dan superoksida) karena ukurannya yang kecil. Ini menarik elektron pada anion yang lebih kompleks menuju salah satu atom oksigen penyusunnya, membentuk ion oksida dan atom oksigen. Hal ini menyebabkan lithium membentuk oksida secara eksklusif hasil reaksi dengan oksigen pada suhu kamar. Efek ini melemah secara drastis untuk natrium dan kalium yang lebih besar, yang memungkinkannya membentuk peroksida yang kurang stabil. Rubidium dan cesium, di bagian bawah golongan, berukuran sangat besar sehingga bahkan superoksida yanh paling tidak stabil pun bisa terbentuk. Oleh karena superoksida melepaskan energi paling banyak ketika terbentuk, superoksida lebih mudah terbentuk untuk logam alkali yang lebih besar di mana anion yang lebih kompleks tidak terpolarisasi. (Oksida dan peroksida untuk logam alkali ini ada, tetapi tidak terbentuk pada reaksi langsung logam dengan oksigen pada kondisi standar.)[34] Sebagai tambahan, kecilnya ukuran ion Li+ dan O2- memberi kontribusi pada pembentukan struktur kisi ionik yang stabil. Namun, dalam kondisi terkendali, semua logam alkali, kecuali fransium, diketahui membentuk oksida, peroksida, dan superoksidanya. Peroksida dan superoksida logam alkali adalah oksidator kuat. Natrium peroksida dan kalium superoksida bereaksi dengan karbon dioksida membentuk logam alkali karbonat dan gas oksigen, yang memungkinkannya digunakan sebagai pemurni udara kapal selam; adanya uap air, yang secara alami hadir melalui nafas, membuat penyingkiran karbondioksida oleh kalium superoksida menjadi jauh lebih efisien.[8][74] Semua logam alkali yang stabil, kecuali lithium, dapat membentuk ozonida s merah (MO3) melalui reaksi suhu rendah dari bubuk hidroksida anhidratnya dengan ozon: ozonida kemudian dapat diekstraksi dengan menggunakan amonia cair.[6]
Rubidium dan cesium bisa membentuk oksida yang lebih rumit daripada superoksida. Rubidium dapat membentuk Rb dan Rb pada oksidasi di udara, sedangkan caesium membentuk berbagai macam oksida, seperti ozonide CsO3[75][76] dan beberapa suboksida berwarna cerah;[77] seperti Cs, Cs, Cs, Cs (hijau tua[78]), CsO, Cs,[79] dan juga Cs.[80][81] Oksida yang disebut terakhir dapat dipanaskan pada kondisi vakum untuk menghasilkan Cs.[82]
Kalkogenida
[sunting | sunting sumber]Analog dengan oksida, logam alkali juga dapat bereaksi dengan kalkogen yang lebih berat (belerang, selenium, tellurium, dan polonium), dan semua alkali logam kalkogenida telah dikenal (kecuali kalkogenida francium). Reaksi dengan kalkogen berlebih juga dapat menghasilkan kalkogenida yang lebih rendah, dengan ion kalkogen yang mengandung rantai atom kalkogen yang bersangkutan. Misalnya, natrium dapat bereaksi dengan belerang membentuk sulfida (Na2S) dan berbagai polisulfida dengan rumus Na2Sx (x dari 2 sampai 6), yang mengandung ion S.[8] Oleh karena alkalinitas ion Se2- dan Te2-, selenida dan tellurida logam alkali bersifat basa dalam larutan; ketika direaksikan langsung dengan selenium dan telurium, poliselenida dan politellurida logam alkali terbentuk bersamaan dengan selenida dan tellurida dengan ion Se dan Te.[83] Polonida logam alkali adalah semua senyawa ionik yang mengandung ion Po2-; mereka sangat stabil secara kimia dan dapat diproduksi dengan reaksi langsung dari unsur-unsurnya pada suhu sekitar 300-400 °C.[6][84][85]
Hidrida dan halida
[sunting | sunting sumber]Logam alkali merupakan unsur yang paling elektropositif pada tabel periodik sehingga cenderung membentuk ikatan ion dengan unsur yang paling elektronegatif pada tabel periodik, halogen, membentuk garam yang dikenal sebagai halida logam alkali. Reaksinya sangat hebat dan terkadang bisa mengakibatkan ledakan.[6] Ini termasuk natrium klorida, yang dikenal sebagai garam pada umumnya. Reaktivitasnya meningkat dari litium ke cesium dan turun dari fluor ke iodium. Semua halida logam alkali memiliki rumus MX dengan M adalah logam alkali dan X adalah halogen. Mereka semua berupa padatan kristal ionik ionik berwarna.[5][34] Semua halida logam alkali larut dalam air kecuali lithium fluorida (LiF), yang tidak larut dalam air karena entalpi kisinya yang sangat tinggi. Tingginya entalpi kisi lithium fluorida akibat dari ukuran ion Li+ dan F- yang kecil, menyebabkan interaksi elektrostatik di antara mereka menjadi kuat:[5] Efek serupa terjadi pada magnesium fluorida, dimana lithium memiliki hubungan diagonal.[6] Logam alkali juga bereaksi serupa dengan hidrogen membentuk hidrida logam alkali.[8]
Kompleks koordinasi
[sunting | sunting sumber]
|

| |
koordinasi 18-mahkota-6 dari ion kalium
|
Struktur 2.2.2-Kriptand menyelimuti satu kation kalium (ungu). Pada keadaan kristal, diperoleh menggunakan difraksi sinar-X.[86]
|
Kation logam alkali biasanya tidak membentuk kompleks koordinasi dengan basa Lewis sederhana karena muatannya yang rendah hanya +1 dan ukurannya yang relatif besar; dengan demikian ion Li+ paling banyak membentuk senyawa kompleks dan semakin berat ion logam alkali, semakin sedikit yang terbentuk. Dalam larutan akuatik, ion logam alkali berada sebagai kompleks oktahedral heksahidrat ([M(H2O)6)]+), kecuali ion lithium, yang karena ukurannya yang kecil membentuk kompleks tetrahedral tetrahidrat ([Li(H2O)4)]+); logam alkali membentuk kompleks ini karena ion mereka tertarik oleh gaya elektrostatik dari molekul air yang bersifat polar. Oleh karena itu, garam anhidrat yang mengandung kation logam alkali sering digunakan sebagai desikan.[8] Logam basa juga mudah membentuk kompleks dengan eter mahkota (misalnya 12-mahkota-4 untuk Li+, 15-mahkota-5 untuk Na+, dan 18-mahkota-6 untuk K+) dan kriptan karena daya tarik elektrostatik.[8]
Larutan amonia
[sunting | sunting sumber]Logam alkali larut perlahan dalam amonia cair, membentuk gas hidrogen dan amida logam alkali (MNH2, dengan M mewakili logam alkali): ini pertama kali dicatat oleh Humphry Davy pada tahun 1809 dan ditemukan kembali oleh W. Weyl pada tahun 1864. Prosesnya dapat dipercepat menggunakan katalis. Larutan serupa dibentuk oleh logam alkali tanah divalen berat dan lantanida kalsium, stronsium, barium, europium, dan ytterbium. Garam amida tidak mudah larut dan mudah mengendap dari larutan, meninggalkan larutan amonia logam alkali yang berwarna cerah. Pada tahun 1907, Charles Krause mengidentifikasi warnanya karena adanya elektron tersolvasi, yang berkontribusi pada tingginya konduktivitas listrik larutan ini. Pada konsentrasi rendah (di bawah 3 M), larutannya berwarna biru tua dan memiliki sepuluh kali konduktivitas larutan natrium klorida dalam air; pada konsentrasi yang lebih tinggi (di atas 3 M), larutannya berwarna tembaga dan memiliki konduktivitas mendekati konduktivitas logam cair seperti raksa.[6][8][87] Selain garam amida logam alkali dan elektron tersolvasi, larutan amonia tersebut juga mengandung kation logam alkali (M+), atom logam alkali netral (M), molekul logam alkali diatomik (M2) dan anion logam alkali (M−). Ketiganya tidak stabil dan akhirnya menjadi amida logam alkali yang lebih stabil secara termodinamika dan gas hidrogen. Elektron tersolvasi adalah reduktor kuat dan sering digunakan dalam sintesis kimia.[8]
Organologam
[sunting | sunting sumber]
Sebagai logam alkali terkecil, lithium membentuk berbagai senyawa organologam paling beragam dan paling stabil, melalui ikatan kovalen. Senyawa organolithium adalah padatan atau cairan volatil non-konduktif yang meleleh pada suhu rendah, dan cenderung membentuk oligomer dengan struktur (RLi)x dengan R adalah gugus organik. Oleh karena sifat elektropositif lithium menempatkan sebagian besar densitas muatan ikatan pada atom karbon, yang secara efektif membentuk karbanion, senyawa organolithium adalah basa dan nukleofil yang sangat kuat. Butillithium sering digunakan sebagai basa dan tersedia secara komersial. Contoh senyawa organolithium adalah metillithium ((CH3Li)x), yang hadir dalam bentuk tetramer (x = 4) dan heksamer (x = 6).[8][88]
Aplikasi senyawa organonatrium dalam kimia terbatas, karena persaingan dari senyawa organolithium, yang tersedia secara komersial dan menunjukkan reaktivitas yang lebih baik. Senyawa organonatrium utama yang penting secara komersial adalah natrium siklopentadiena. Natrium tetrafenilborat juga dapat diklasifikasikan sebagai senyawa organonatrium karena natrium dalam keadaan padat terikat pada gugus aril. Senyawa organologam dari logam alkali yang lebih tinggi lebih reaktif daripada senyawa organonatrium dan manfaatnya terbatas. Pereaksi yang terkenal adalah basa Schlosser, suatu campuran n-butillithium dan kalium tert-butoksida. Pereaksi ini bereaksi dengan propena membentuk senyawa alilkalium (KCH). cis-2-Butena dan trans-2-butena berada dalam kesetimbangan ketika bereaksi dengan logam alkali. Sementara isomerisasi berlangsung cepat dengan lithium dan natrium, isomerisasi berlangsung lambat dengan logam alkali yang lebih tinggi. Logam alkali yang lebih tinggi juga menyukai konformasi kongesti akibat halangan sterik.[89] Beberapa struktur kristal senyawa organokalium telah dilaporkan, memantapkan bahwa senyawa tersebut, seperti senyawa natrium, bersifat polimer.[90] Senyawa organonatrium, organokalium, organorubidium dan organocaesium sebagian besar bersifat ionik dan (hampir) tidak larut dalam pelarut nonpolar.[8]
Pengembangan
[sunting | sunting sumber]
Meskipun fransium adalah logam alkali terberat yang telah ditemukan, telah ada beberapa karya teoretis yang memprediksi karakteristik fisika dan kimia logam alkali hipotetis yang lebih berat. Sebagai unsur unsur periode 8 yang pertama, unsur yang belum ditemukan ununennium (unsur 119) diprediksi menjadi logam alkali berikutnya setelah fransium dan berperilaku seperti kongenernya yang lebih ringan; namun, diperkirakan juga berbeda dari logam alkali yang lebih ringan dalam beberapa sifat.[36] Sifat kimianya diprediksi akan mendekati nilai kalium[92] atau rubidium[36], bukan cesium atau fransium. Ini di luar kebiasaan tren periodik, dengan mengabaikan efek relativistik akan memprediksi ununennium lebih reaktif daripada cesium dan fransium. Penurunan reaktivitas disebabkan oleh stabilisasi relativistik elektron valensi ununennium, yang meningkatkan energi ionisasi pertama dan menurunkan jari-jari logam dan jari-jari ion;[92] efek ini sudah terlihat pada fransium.[36] Ini mengasumsikan bahwa ununenium akan, secara kimiawi, berperilaku sebagai logam alkali, yang, mungkin tidak benar, merupakan akibat efek relativistik.[93] Stabilisasi relativistik orbital 8s juga meningkatkan afinitas elektron ununenium jauh melampaui cesium dan fransium; memang, ununenium diperkirakan memiliki afinitas elektron tertinggi daripada semua logam alkali yang lebih ringan daripadanya. Efek relativistik juga menyebabkan penurunan yang sangat besar dalam polarisabilitas ununenium.[36] Di sisi lain, ununennium diperkirakan akan melanjutkan tren titik leleh menurun ke bawah golongan, diperkirakan memiliki titik leleh antara 0 °C dan 30 °C.[36]

Stabilisasi elektron valensi ununennium yang berdampak pada kontraksi orbital 8s menyebabkan radius atom turun menjadi 240 pm,[36] sangat dekat dengan rubidium (247 pm),[5] sehingga kimia ununennium pada tingkat oksidasi +1 lebih mirip dengan kimia rubidium daripada fransium. Di sisi lain, jari-jari ion Uue+ diperkirakan lebih besar daripada Rb+, karena orbital 7p tidak stabil dan dengan demikian lebih besar daripada orbital-p dari kelopak yang lebih rendah. Ununennium juga dapat menunjukkan tingkat oksidasi +3,[36] yang tidak terlihat pada logam alkali lainnya,[6] di samping tingkat oksidasi +1 yang merupakan karakteristik logam alkali lainnya dan juga merupakan tingkat oksidasi utama semua logam alkali yang dikenal: ini karena destabilisasi dan perluasan dari spinor 7p3/2, menyebabkan elektron terluarnya memiliki energi ionisasi yang lebih rendah daripada yang diharapkan.[6][36] Memang, banyak senyawa ununenium diharapkan memiliki karakter kovalen yang besar, karena keterlibatan elektron 7p3/2 dalam ikatan.[37]
Tidak banyak penelitian yang dilakukan untuk memprediksi sifat-sifat logam alkali setelah ununenium. Meskipun ekstrapolasi sederhana dari tabel periodik akan menempatkan elemen 169, unheksenium, di bawah ununenium, perhitungan Dirac-Fock memprediksi bahwa logam alkali berikutnya setelah ununennium sebenarnya adalah unsur 165, unhekspentium, yang diperkirakan memiliki konfigurasi elektron [Og] 5g18 6f14 7d10 8s2 8p21/2 9s1.[36][91] Perhitungan lebih lanjut menunjukkan bahwa unhekspentium akan mengikuti tren peningkatan energi ionisasi setelah cesium, memiliki energi ionisasi yang sebanding dengan natrium, dan juga melanjutkan kecenderungan penurunan jari-jari atom setelah cesium, memiliki jari-jari atom yang sebanding dengan kalium.[36] Namun, elektron 7d dari unhekspentium dapat juga dapat berpartisipasi dalam reaksi kimia bersama dengan elektron 9s, yang memungkinkan tingkat oksidasi lebih dari +1 dan bahkan mungkin membuat unhekspentium berperilaku seperti unsur golongan boron atau unsur golongan 11 daripada logam alkali.[36][94] Oleh karena logam alkali dan alkali tanah keduanya merupakan unsur blok-s, prediksi tren dan sifat ununennium dan unhekspentium juga sebagian besar sangat mirip dengan logam alkali tanah yang sesuai unbinilium (Ubn) dan unheksheksium (Uhh).[36]
Kemungkinan sifat logam alkali lebih lanjut setelah unhekspentium belum dieksplorasi pada tahun 2012. Pada periode 8 dan selanjutnya pada tabel periodik, efek relativistik dan struktur kelopak menjadi sangat kuat sehingga ekstrapolasi dari kongenernya yang lebih ringan menjadi sama sekali tidak akurat. Selain itu, efek relativistik dan struktur kelopak (yang menstabilkan orbital s dan mendestabilkan serta memperluas orbital d, f, dan g pada kelopak yang lebih tinggi) memiliki efek yang berlawanan, menyebabkan perbedaan yang lebih besar antara perhitungan relativistik dan non-relativistik terhadap sifat unsur dengan nomor atom tinggi tersebut.[36] Minat terhadap sifat kimia ununennium dan unhekspentium berasal dari fakta bahwa kedua unsur tersebut berada dekat dengan lokasi yang diharapkan pada pulau stabilitas, berpusat pada unsur 122 (306Ubb) dan 164 (482Uhq).[95][96][97]
Logam pseudo-alkali
[sunting | sunting sumber]Hidrogen
[sunting | sunting sumber]
Unsur hidrogen, dengan satu elektron per atom netral, biasanya ditempatkan di puncak Golongan 1 tabel periodik untuk kemudahan, tetapi hidrogen biasanya tidak dianggap sebagai logam alkali;[98] bila dianggap logam alkali, itu pun karena sifat atomnya dan bukan sifat kimianya.[99] Dalam kondisi normal, hidrogen murni berada sebagai gas diatomik yang terdiri dari dua atom per molekul (H2);[100] namun, logam alkali hanya membentuk molekul diatomik (seperti dilithium, Li2) pada suhu tinggi, saat berada dalam keadaan gas.[101]
Hidrogen, seperti logam alkali, memiliki satu elektron valensi[102] dan mudah bereaksi dengan halogen[102] namun kesamaannya berakhir sampai di sini.[102] Penempatannya di atas lithium terutama karena konfigurasi elektronnya dan bukan sifat kimianya.[98][102] Kadang-kadang ditempatkan di atas karbon karena elektronegativitas mereka serupa[103] atau di atas fluor karena sifat kimianya mirip.[102][103]
Energi ionisasi pertama hidrogen (1312,0 kJ/mol) jauh lebih tinggi daripada logam alkali.[104][105] Oleh karena hanya satu elektron tambahan yang diperlukan untuk memenuhi kelopak terluar atom hidrogen, hidrogen sering berperilaku seperti halogen, membentuk ion hidrida yang negatif, dan kadang-kadang dianggap sebagai halogen.[102] (Logam alkali juga bisa membentuk ion negatif, yang dikenal sebagai alkalida, tapi ini tidak stabil dan sekadar memenuhi keingintahuan di laboratorium.)[29][30] Diharapkan untuk beberapa waktu hidrogen cair akan menunjukkan sifat logam;[103] sementara ini terbukti bukan masalah, di bawah tekanan yang sangat tinggi, seperti yang ditemukan pada inti Jupiter dan Saturnus, hidrogen memang menjadi logam dan berperilaku seperti logam alkali; pada fase ini, dikenal sebagai hidrogen metalik.[106] resistivitas listrik hidrogen cair pada 3000 K kira-kira sama dengan rubidium dan cesium cair pada 2000 K pada tekanan masing-masing saat mereka mengalami transisi nonlogam menjadi logam.[107]
Konfigurasi elektron 1s1 hidrogen, yang secara superfisial mirip dengan logam alkali (ns1), adalah unik, karena tidak ada subkelopak 1p. Oleh karena itu, ia dapat kehilangan elektron membentuk hidron H+, atau menarik elektron membentuk ion hidrida H−.[6] Dalam kasus sebelumnya, ini menyerupai logam alkali secara superfisial; dalam kasus berikutnya, menyerupai halogen, tetapi perbedaan karena kurangnya subkelopak 1p cukup penting sehingga kedua golongan tidak sesuai dengan sifat hidrogen.[6] Golongan 14 adalah yang paling sesuai dalam hal sifat termodinamika seperti energi ionisasi dan afinitas elektron, tetapi tidak satu pun dari tiga penempatan sepenuhnya memuaskan.[103] Sebagai contoh sifat tidak lazim hidrogen antara lain konfigurasi elektron yang tidak biasa dan ukurannya yang kecil, ion hidrogen sangat kecil (jari-jari sekitar 150 fm dibandingkan dengan ukuran 50-220 pm untuk kebanyakan atom dan ion lainnya) dan tidak ada sistem yang berhubungan selain dalam asosiasi dengan atom atau molekul lainnya. Memang, transfer proton antara bahan kimia adalah dasar kimia asam-basa.[6] Hal yang juga unik adalah kemampuan hidrogen untuk membentuk ikatan hidrogen, yang merupakan efek dari transfer muatan, elektrostatik, dan fenomana yang berhubungan dengan elektron.[103] Sementara ikatan lithium yang analog juga diketahui, kebanyakan merupakan elektrostatik.[103] Namun demikian, hidrogen dapat melakukan peran struktural yang sama seperti logam alkali dalam beberapa molekul kristal, dan memiliki hubungan dekat dengan logam alkali paling ringan (terutama lithium).[108]
Amonium
[sunting | sunting sumber]Ion amonium (NH) memiliki sifat yang sangat mirip dengan logam alkali berat, bertindak selaku intermediat logam alkali antara kalium dan rubidium,[109] dan sering dianggap memiliki hubungan yang dekat.[110][111][112] Sebagai contoh, sebagian besar garam logam alkali dapat larut dalam air, suatu sifat yang dimiliki pula oleh garam amonium.[113] Amonium diharapkan berperilaku stabil seperti logam (ion NH dalam lautan elektron) pada tekanan yang sangat tinggi (meskipun kurang dari tekanan tertentu terjadi transisi dari isolator menjadi berperilaku metalik, yaitu pada 100 GPa), dan mungkin bisa terjadi di dalam es raksasa Uranus dan Neptunus, yang mungkin memiliki dampak signifikan pada medan magnet interior mereka.[111][112] Telah diperkirakan bahwa transisi dari campuran amonia dan molekul dihidrogen menjadi amonium metalik dapat terjadi pada tekanan di bawah 25 GPa.[111]
Talium
[sunting | sunting sumber]
Talium adalah unsur terberat yang stabil pada golongan 13 tabel periodik. Di bagian bawah tabel periodik, efek pasangan inert cukup kuat, karena stabilisasi relativistik orbital 6s dan penurunan energi ikatan seiring dengan peningkatan ukuran atom sehingga jumlah energi yang dilepaskan dalam pembentukan dua ikatan lagi tidak sebanding dengan tingginya energi ionisasi elektron 6s.[6] Talium menunjukkan tingkat oksidasi +1[6] seperti yang ditunjukkan oleh semua logam alkali yang diketahui,[6] dan senyawa talium dengan talium dengan tingkat oksidasi +1 sangat mirip dengan senyawa kalium atau perak yang sesuai secara stoikiometri karena kemiripan jari-jari ion Tl+ (164 pm), dengan ion K+ (152 pm) dan Ag+ (129 pm).[114][115] Ini kadang-kadang dianggap sebagai logam alkali di benua Eropa (tapi tidak di Inggris) pada tahun-tahun awal setelah penemuannya[115] dan diletakkan tepat setelah cesium sebagai logam alkali keenam dalam tabel periodik Dmitri Mendeleev tahun 1869 dan tabel periodik Julius Lothar Meyer tahun 1868.[116] (Tabel periodik Mendeleev tahun 1871 dan tabel periodik Meyer tahun 1870 menempatkan talium pada posisi saat ini dalam golongan boron dan membiarkan ruang di bawah cesium kosong.)[116] Namun, talium juga menampilkan tingkat oksidasi +3,[6] yang tidak ditunjukkan oleh logam alkali yang dikenal[6] (walaupun ununenium, logam alkali ketujuh yang belum ditemukan, diprediksi mungkin menunjukkan tingkat oksidasi +3).[36] Logam alkali keenam yang dikenal sekarang adalah fransium.[117] Sementara Tl+ distabilkan oleh efek pasangan inert, pasangan inert elektron 6s ini masih dapat berpartisipasi secara kimiawi, sehingga elektron ini secara stereokimia aktif dalam larutan akuatik. Selain itu, talium halida (kecuali TlF) sukar larut dalam air, dan TlI memiliki struktur yang tidak biasa karena adanya pasangan inert dalam talium.[118]
Tembaga, perak, dan emas
[sunting | sunting sumber]Logam golongan 11 (atau logam koin), tembaga, perak, dan emas, biasanya dikategorikan sebagai logam transisi karena mereka dapat membentuk ion dengan kelopak d yang tidak lengkap. Secara fisik, mereka memiliki titik lebur yang relatif rendah dan nilai elektronegativitas tinggi yang terkait dengan logam pasca-transisi. "Subkelopak d yang terisi dan elektron bebas s pada Cu, Ag, dan Au berkontribusi terhadap tingginya konduktivitas listrik dan termal mereka. Logam transisi di sebelah kiri golongan 11 mengalami interaksi antara elektron s dan subkelopak d yang terisi sebagian sehingga menurunkan mobilitas elektron."[119] Secara kimia, logam golongan 11 berperilaku seperti logam golongan utama dengan tingkat valensi +1 mereka, dan karena itu berkorelasi dengan logam alkali: ini adalah salah satu alasan mengapa label mereka sebelumnya "Golongan IB", yang paralel dengan logam alkali "Golongan IA". Mereka kadang diklasifikasikan sebagai logam pasca-transisi.[120] Bagaimanapun, spektrum mereka analog dengan logam alkali.[121]
Pada tabel periodik Mendeleev tahun 1871, tembaga, perak, dan emas muncul dua kali, pertama di bawah golongan VIII (dengan triad besi dan logam golongan platina), dan kedua, di bawah golongan IB. Golongan IB tetap diberi tanda kurung untuk mencatat bahwa itu adalah tentatif. Kriteria utama Mendeleev dalam melakukan penggolongan adalah tingkat oksidasi maksimum suatu unsur: atas dasar itu, unsur golongan 11 tidak dapat diklasifikasikan dalam golongan IB, karena adanya senyawa Cu(II) dan Au(III) yang diketahui pada saat itu.[121] Bagaimanapun, menghilangkan golongan IB akan menjadikan golongan I sebagai satu-satunya golongan utama (golongan VIII diberi label golongan transisi) sehingga tidak memiliki bifurkasi A-B.[121] Segera setelah itu, sebagian besar kimiawan memilih untuk mengklasifikasikan unsur-unsur ini dalam golongan IB dan menyingkirkannya dari golongan VIII untuk menghasilkan simetri: ini adalah klasifikasi yang dominan sampai munculnya tabel periodik modern 18 kolom, yang memisahkan logam alkali dan logam golongan 11.[121]
Logam koin secara tradisional dianggap sebagai sub golongan logam alkali, karena mereka berbagi karakteristik konfigurasi elektron s1 logam alkali (golongan 1: p6s1; golongan 11: d10s1). Namun, kesamaan tersebut sebagian besar terbatas pada stoikiometri senyawa +1 dari kedua golongan, dan bukan pada sifat kimianya.[6] Ini berasal dari subkelopak d yang terisi yang memberikan efek perisai jauh lebih lemah pada elektron terluar daripada subkulit p yang terisi, sehingga logam koin memiliki energi ionisasi pertama yang jauh lebih tinggi dan jari-jari ion yang lebih kecil daripada logam alkali kesesuaiannya.[6] Selanjutnya, mereka memiliki titik leleh, kekerasan, dan densitas yang lebih tinggi, serta reaktivasi dan kelarutan yang lebih rendah dalam amonia cair, sejalan dengan lebih banyaknya karakter kovalen pada senyawa mereka.[6] Terakhir, logam alkali berada di puncak deret elektrokimia, sedangkan logam koin hampir berada di bagian paling bawah.[6] Kelopak d yang terisi pada logam koin jauh lebih mudah terganggu daripada kelopak p yang terisi pada logam alkali, sehingga energi ionisasi kedua dan ketiga lebih rendah, yang memungkinkan tingkat oksidasi yang lebih tinggi daripada +1 dan kimia koordinasi yang lebih kaya, sehingga memberi karakter logam golongan 11 dengan jelas sebagai logam transisi.[6] Hal terpenting adalah emas membentuk senyawa ionik dengan rubidium dan cesium, di mana ia membentuk ion aurida (Au−) yang juga terdapat dalam bentuk tersolvasi dalam larutan amonia cair: di sini emas berperilaku sebagai pseudohalogen karena konfigurasi 5d106s1 nya kekurangan satu elektron dibandingkan konfigurasi kelopak kuasi-tertutup raksa (5d106s2).[6]
Sejarah
[sunting | sunting sumber]
Senyawa natrium telah dikenal sejak zaman kuno; garam (bahasa Inggris: salt) (natrium klorida) telah menjadi komoditas penting dalam aktivitas manusia, seperti yang disaksikan oleh kata bahasa Inggris salary, mengacu pada salarium, uang dibayarkan kepada tentara Romawi untuk membeli garam.[122] Sementara potas (kalium oksida) telah digunakan sejak zaman kuno, tetapi tidak dipahami sejarahnya sebagai zat yang secara mendasar berbeda dari garam mineral natrium. Georg Ernst Stahl memperoleh bukti eksperimental yang mengarah pada perbedaan mendasar garam natrium dan kalium pada 1702,[123] dan Henri Louis Duhamel du Monceau mampu membuktikan perbedaan ini pada tahun 1736.[124] Komposisi kimia yang tepat dari senyawa kalium dan natrium, serta statusnya sebagai unsur kimia kalium dan natrium, belum diketahui saat itu, hingga pada tahun 1789 Antoine Lavoisier memasukkan alkali dalam daftar unsur kimia.[125][126]
Kalium murni pertama kali diisolasi pada tahun 1807 di Inggris oleh Sir Humphry Davy, yang mengambilnya dari kaustik potas (KOH, kalium hidroksida) dengan cara elektrolisis lelehan garam menggunakan metode sel volta yang baru ditemukan. Usaha-usaha sebelumnya untuk elektrolisis larutan garam dalam air tidak berhasil karena reaktivitas ekstrem kalium.[6] Kalium adalah logam pertama yang diisolasi dengan cara elektrolisis.[127] Kemudian pada tahun yang sama, Davy melaporkan ekstraksi natrium dari zat yang serupa soda api (NaOH, lindi) dengan teknik serupa, menunjukkan unsur-unsurnya, dan dengan demikian garamnya juga berbeda.[125][126][128][129] Belakangan pada tahun itu, potongan pertama logam natrium cair murni juga dipersiapkan oleh Humphry Davy melalui elektrolisis soda api cair (sekarang disebut natrium hidroksida).[128]

Petalite (LiAlSi4O10) ditemukan pada tahun 1800 oleh kimiawan Brazil José Bonifácio de Andrada dalam sebuah tambang di pulau Utö, Swedia.[130][131][132] Namun, baru pada tahun 1817, saat Johan August Arfwedson yang bekerja di laboratorium milik kimiawan Jöns Jacob Berzelius, mendeteksi adanya unsur baru ketika menganalisis bijih petalite.[133][134] Unsur baru ini ditemukannya membentuk senyawa yang mirip dengan natrium dan kalium, medkipun karbonat dan hidroksidanya kurang larut dalam air dan lebih basa daripada logam alkali lainnya.[135] Berzelius menamakan material baru tersebut "lithion/lithina", dari bahasa Yunani λιθoς (dibaca lithos yang berarti "batu"), untuk mencerminkan bahwa material tersebut ditemukan dalam mineral padat, berlawanan dengan kalium, yang ditemukan di abu tanaman, dan natrium, yang dikenal terutama karena kelimpahannya yang tinggi dalam darah hewan. Dia memberi nama logam di dalam material tersebut sebagai "lithium".[21][131][134] Lithium, natrium, dan kalium merupakan bagian dari penemuan periodisitas, Karena mereka termasuk di antara rangkaian unsur triad dalam golongan yang sama seperti dinyatakan oleh Johann Wolfgang Döbereiner pada tahun 1850 sebagai memiliki kemiripan sifat.[116]

Rubidium dan cesium adalah unsur pertama yang ditemukan dengan menggunakan spektroskop, instrumen ditemukan pada tahun 1859 oleh Robert Bunsen dan Gustav Kirchhoff.[136] Tahun berikutnya, mereka menemukan cesium dalam air mineral dari Bad Dürkheim, Jerman. Penemuan rubidium terjadi pada tahun berikutnya di Heidelberg, Jerman. Mereka menemukannya di dalam mineral lepidolit.[137] Nama rubidium dan cesium berasal dari garis yang paling menonjol dalam spektrum emisi mereka: garis merah terang untuk rubidium (dari bahasa Latin: rubidus, yang berarti merah tua atau merah terang), dan garis biru langit untuk cesium (dari bahasa Latin: caesius, yang berarti biru langit).[138][139]
Sekitar tahun 1865 John Newlands menghasilkan serangkaian makalah yang mencantumkan unsur-unsurnya sesuai peningkatan berat atom serta keserupaan sifat fisika dan kimia, dengan interval pengulangan delapan; ia menyamakan periodisitas semacam itu dengan oktaf musik.[140][141] Versinya menempatkan semua logam alkali yang dikenal kemudian (lithium to cesium), beserta tembaga, perak, dan thallium (yang menunjukkan karakteristik tingkat oksidasi logam alkali +1), bersama-sama ke dalam satu golongan. Tabelnya menempatkan hidrogen bersama-sama dengan halogen.[116]
Setelah tahun 1869, Dmitri Mendeleev mengusulkan tabel periodiknya dengan menempatkan lithium di bagian atas golongan diikuti dengan natrium, kalium, rubidium, cesium, dan thallium.[142] Dua tahun kemudian, Mendeleev merevisi tabelnya, menempatkan hidrogen pada kelompok 1 di atas litium, dan juga memindahkan thallium ke golongan boron. Dalam versi 1871 ini, tembaga, perak, dan emas ditempatkan di dua tempat, pertama sebagai bagian dari golongan IB, dan kedua sebagai bagian dari "golongan VIII" yang mencakup golongan 8 sampai 11 saat ini.[121][note 10] Setelah diperkenalkannya tabel 18 kolom, unsur golongan IB dipindahkan ke posisi mereka saat ini di blok d, sedangkan logam alkali tetap di golongan IA. Kemudian nama golongan tersebut diubah menjadi golongan 1 pada tahun 1988.[143] Nama trivial "logam alkali" berasal dari fakta bahwa hidroksida unsur-unsur golongan 1 semua adalah alkali kuat ketika dilarutkan dalam air.[5]
Setidaknya ada empat penemuan yang salah dan tidak lengkap[44][45][144][145] aebelum Marguerite Perey dari Curie Institute di Paris, Prancis menemukan francium pada tahun 1939 dengan memurnikan sampel aktinium-227, yang telah dilaporkan memiliki energi peluruhan 220 keV. Namun, Perey mencatat partikel peluruhan dengan tingkat energi di bawah 80 keV. Perey mengira aktivitas peluruhan ini mungkin disebabkan oleh produk peluruhan yang tidak teridentifikasi sebelumnya, yang terpisah saat pemurnian, tapi muncul kembali dari aktinium-227 murni. Berbagai tes mengeliminasi kemungkinan unsur yang tidak diketahui menjadi thorium, radium, timbal, bismut, atau thallium. Produk baru tersebut menunjukkan sifat kimia dari logam alkali (seperti kopresipitasi dengan garam cesium), yang membuat Perey yakin bahwa itu adalah unsur 87, yang disebabkan oleh peluruhan alfa dari aktinium-227.[146] Perey kemudian mencoba untuk menentukan proporsi peluruhan beta terhadap peluruhan alfa pada aktinium-227. Uji pertamanya menentukan percabangan alfa sebesar 0,6%, sebuah angka yang kemudian direvisi menjadi 1%.[147]
- unknown element actinium. unknown element francium. 223
88Ra
Unsur berikutnya di bawah francium (eka-fransium) dalam tabel periodik adalah ununennium (Uue), unsur 119.[36] Sintesis ununennium pertama kali dicoba pada tahun 1985 dengan membombardir target einsteinium-254 dengan ion kalsium-48 pada akselerator superHILAC di Berkeley, California. Tidak ada atom yang diidentifikasi, hingga 300 nb.[148][149]
Sangat tidak mungkin[148] reaksi ini akan mampu menciptakan atom ununennium dalam waktu dekat, mengingat sangat sulit untuk menghasilkan jumlah einsteinium-254 yang mencukupi, untuk memenuhi produksi unsur ultraberat karena massanya yang besar, waktu paruh yang relatif lama (270 hari), dan ketersediaan yang signifikan sejumlah beberapa mikrogram.[150] Untuk membuat target yang cukup besar untuk meningkatkan sensitivitas percobaan ke tingkat yang dipersyaratkan; einsteinium belum ditemukan di alam dan hanya diproduksi di laboratorium, dan dalam jumlah yang lebih kecil daripada yang dibutuhkan untuk sintesis efektif unsur ultraberat. Namun, mengingat bahwa ununenium hanyalah unsur periode 8 yang pertama dalam tabel periodik perluasan, mungkin akan ditemukan dalam waktu dekat melalui reaksi lain, dan memang dicoba untuk mensintesisnya pada tahun 2019 dan 2020 yang saat ini sedang direncanakan di laboratorium di Jepang dan Rusia.[151] Saat ini, tidak ada satupun unsur periode 8 yang ditemukan, dan juga mungkin, karena ketidakstabilan tetesan nuklir, bahwa hanya unsur di bawah periode 8, sampai sekitar unsur 128, yang secara fisika mungkin dilakukan.[92][152] Tidak ada upaya sintesis yang dilakukan untuk logam alkali yang lebih berat, seperti unhekspentium, karena nomor atomnya yang sangat tinggi: mereka memerlukan teknologi baru yang lebih kuat untuk mewujudkannya.[36]
Keterjadian
[sunting | sunting sumber]Dalam sistem tata surya
[sunting | sunting sumber]
Aturan Oddo–Harkins menyatakan bahwa unsur dengan nomor atom genap lebih umum daripada mereka dengan nomor atom ganjil, kecuali hidrogen. Aturan ini berpendapat bahwa unsur-unsur dengan nomor atom ganjil memiliki satu proton yang tak berpasangan dan cenderung menangkap yang lain, sehingga meningkatkan nomor atomnya. Dalam unsur dengan nomor atom genap, proton berpasangan, dengan masing-masing anggota pasangan mengimbangi putaran yang lain, sehingga meningkatkan stabilitas.[154][155][156] Semua logam alkali memiliki bilangan atom ganjil dan, dalam Tata Surya, tidak selazim unsur-unsur dengan nomor atom yang berdekatan dengan mereka (gas mulia dan logam alkali tanah). Logam alkali yang lebih berat juga kurang berlimpah daripada yang ringan karena logam alkali mulai rubidium dan seterusnya hanya dapat disintesis dalam supernova dan tidak dalam nukleosintesis stelar. Lithium juga jauh lebih sedikit daripada natrium dan kalium karena disintesis dengan buruk dalam nukleosintesis Dentuman Besar dan bintang: Dentuman Besar hanya bisa menghasilkan lithium, berilium dan boron dalam jumlah renik karena tidak adanya inti yang stabil dengan 5 atau 8 nukleon, dan nukleosintesis bintang hanya bisa melewati kemacetan ini dengan proses tripel-alfa, memfusi tiga inti helium untuk membentuk karbon, dan melewatkan ketiga unsur tersebut.[153]
Di Bumi
[sunting | sunting sumber]
Bumi terbentuk dari awan materi yang sama dengan yang membentuk Matahari, tetapi planet-planet memperoleh komposisi yang berbeda selama pembentukan dan evolusi tata surya. Pada gilirannya, sejarah alami Bumi menyebabkan bagian-bagian planet ini memiliki konsentrasi unsur yang berbeda. Massa Bumi kira-kira 5,98×1024 kg. Ini terdiri dari sebagian besar besi (32,1%), oksigen (30,1%), silikon (15,1%), magnesium (13,9%), belerang (2,9%), nikel (1,8%), kalsium (1,5%), dan aluminium (1,4%); dan sisanya 1,2% terdiri dari unsur renik lainnya. Karena segregasi massa, wilayah inti diyakini sebagian besar terdiri dari besi (88,8%), dan, dengan jumlah lebih sedikit, nikel (5,8%), belerang (4,5%), dan unsur renik kurang dari 1%.[157]
Logam alkali, karena reaktifitasnya yang tinggi, tidak terjadi secara alami dalam bentuk murni di alam. Mereka adalah litofil dan karena itu tetap dekat dengan permukaan bumi karena mereka mudah bergabung dengan oksigen dan sangat berasosiasi dengan silika, membentuk mineral dengan kepadatan rendah yang tidak tenggelam ke dalam inti bumi. Kalium, rubidium dan cesium juga unsur tak kompatibel karena besarnya jari-jari ion mereka.[158]
Natrium dan kalium sangat melimpah di bumi, keduanya termasuk dalam sepuluh besar unsur terbanyak dalam kerak bumi;[159][160] natrium menyusun sekitar 2,6% kerak bumi, diukur berdasarkan beratnya, dan membuatnya menjadi, umumnya, unsur paling melimpah keenam[161] dan, khususnya, logam alkali paling melimpah. Kalium menyusun sekitar 1,5% kerak bumi dan merupakan unsur paling melimpah ke-7.[161] Natrium dijumpai dalam banyak mineral yang berbeda, dengan yang paling umum adalah garam biasa (natrium klorida), yang terdapat dalam jumlah masif sebagai terlarut dalam air laut. Deposit padat lainnya antara lain halit, amfibole, kriolit, nitratin, dan zeolit.[161] Banyak dari deposit padat ini terjadi sebagai akibat penguapan laut kuno, yang masih terjadi saat ini di beberapa tempat seperti Great Salt Lake di Utah dan Laut Mati.[6] Selain kelimpahan mereka dalam kerak bumi hampir sama, natrium jauh lebih banyak daripada kalium di samudera, karena ukuran kalium yang lebih besar sehingga garamnya menjadi sukar larut, dan juga karena kalium terikat oleh silikat dalam tanah serta kalium yang terlarut lebih cepat diserap oleh tumbuhan daripada natrium.[6]
Meski memiliki kesamaan kimia, lithium biasanya tidak terjadi bersamaan dengan natrium atau kalium karena ukurannya yang lebih kecil.[6] Karena reaktivitasnya yang relatif rendah, lithium dapat ditemukan dalam air laut dalam jumlah besar; diperkirakan sekitar 0,14 sampai 0,25 bagian per juta (ppm)[162][163] atau 25 mikromolar.[164] Hubungan diagonalnya dengan magnesium menyebabkan lithium sering menggantikan magnesium dalam mineral feromagnesium, dengan konsentrasi krustal (dalam kerak bumi) sekitar 18 ppm, sebanding dengan galium dan niobium. Secara komersial, mineral lithium yang penting adalah spodumena, yang banyak terdapat sebagai deposit melimpah di seluruh dunia.[6]
Rubidium kira-kira memiliki kelimpahan yang setara dengan seng dan lebih melimpah daripada tembaga. Ia terjadi secara alami dalam mineral leucit, polucit, carnalit, zinwaldit, dan lepidolit,[165] meskipun tidak ada satupun yang hanya berisi rubidium tanpa logam alkali lainnya.[6] Cesium lebih melimpah daripada beberapa unsur umum, seperti antimon, kadmium, timah, dan tungsten, tetapi kelimpahannya jauh di bawah rubidium.[24]
Fransium-223, satu-satunya isotop fransium yang terbentuk secara alami,[10][11] adalah produk peluruhan alfa dari aktinium-227 dan dapat dijumpai dalam jumlah renik dalam mineral uranium dan thorium.[166] Dalam sampel uranium, terdapat kira-kira 1 atom fransium untuk setiap 1018 atom uranium.[167][168] Telah dilakukan perhitungan bahwa terdapat sebanyak-banyaknya 30 g fransium dalam kerak bumi sepanjang masa, akibat waktu paruhnya yang sangat pendek, hanya sekitar 22 menit.[169][170]
Produksi dan isolasi
[sunting | sunting sumber]Produksi logam alkali murni sulit dilakukan karena ekstremnya reaktivitas mereka dengan bahan yang umum digunakan, misalnya air.[5][8] Dari bijih silikat mereka, semua logam alkali stabil dapat diperoleh dengan cara yang sama: pertama kali digunakan asam sulfat untuk melarutkan ion logam alkali yang diinginkan dan ion aluminium(III) dari bijih (leaching), kemudian presipitasi basa menghilangkan ion aluminium dari campuran dengan mengendapkannya sebagai hidroksidanya. Sisanya, karbonat logam alkali yang tidak larut kemudian diendapkan secara selektif; garamnya kemudian dilarutkan dalam asam klorida untuk menghasilkan kloridanya. Hasilnya kemudian dibiarkan menguap sehingga logam alkali kemudian bisa diisolasi.[8] Lithium dan natrium biasanya diisolasi melalui elektrolisis dari klorida cairnya, biasanya ditambahkan kalsium klorida untuk menurunkan titik leleh campuran. Namun, logam alkali yang berat lebih sering diisolasi dengan cara yang berbeda, yaitu menggunakan reduktor (biasanya natrium untuk kalium dan magnesium atau kalsium untuk logam alkali yang lebih berat) untuk mereduksi klorida logam alkali. Kemudian dilakukan pemurnian dengan cara distilasi fraksi terhadap produk cairan atau gasnya.[8]
Garam litium harus diekstraksi dari mata air mineral, kolam air garam, dan deposit air garam. Logam diproduksi secara elektrolisis dari campuran litium klorida dan kalium klorida.[171]
Natrium sebagian besar terjadi dalam air laut dan dasar laut kering,[5] tetapi sekarang diproduksi melalui elektrolisis natrium klorida dengan menurunkan titik leleh zat di bawah 700 °C menggunakan sel Downs.[172][173] Natrium yang sangat murni dapat diproduksi melalui dekomposisi termal natrium azida.[174]
Kalium terdapat pada banyak mineral, seperti sylvite (kalium klorida).[5] Sebelumnya, kalium umumnya dibuat dari elektrolisis kalium klorida atau kalium hidroksida,[175] yang ditemukan secara luas di tempat-tempat seperti Kanada, Rusia, Belarus, Jerman, Israel, Amerika Serikat, dan Yordania, dengan metode yang serupa dengan cara produksi natrium pada akhir 1800-an dan awal 1900-an.[176] Kalium dapat juga diproduksi dari air laut. Namun, metode ini bermasalah karena logam kalium cenderung larut dalam lelehan kloridanya dan menguap secara signifikan pada suhu operasi, yang berpotensi membentuk superoksida yang mudah meledak. Akhirnya, logam kalium murni sekarang diproduksi dengan mereduksi kalium klorida cair dengan logam natrium pada suhu 850 °C.[6].
- Na(g) + KCl(l)
 NaCl(l) + K(g)
NaCl(l) + K(g)
Meskipun natrium kurang reaktif dibanding kalium, proses ini dapat berlangsung karena pada suhu tinggi kalium lebih mudah menguap daripada natrium dan dapat dengan mudah didistilasi, sehingga keseimbangan bergeser ke arah kanan untuk menghasilkan lebih banyak gas kalium.[6]

Selama beberapa tahun pada tahun 1950an dan 1960an, produk sampingan dari produksi potasium yang disebut Alkarb merupakan sumber utama rubidium. Alkarb mengandung 21% rubidium sedangkan sisanya adalah kalium dan sebagian kecil cesium.[177] Saat ini produsen cesium terbesar, misalnya Tanco Mine, Manitoba, Kanada, memproduksi rubidium sebagai produk sampingan dari pollucite.[178] Saat ini, metode umum untuk memisahkan rubidium dari kalium dan cesium adalah kristalisasi fraksional dari tawas rubidium dan cesium (Cs, Rb)Al(SO4)2·12H2O, yang menghasilkan tawas rubidium murni setelah sekitar 30 reaksi berbeda.[178][179] Terbatasnya aplikasi dan kurangnya mineral yang kaya akan rubidium membatasi produksi senyawa rubidium hanya 2 sampai 4 ton per tahun.[178] Namun, cesium tidak dihasilkan dari reaksi di atas. Sebagai gantinya, penambangan bijih pollucite adalah metode utama untuk mendapatkan cesium murni, yang diekstraksi dari bijih terutama dengan tiga metode: pencernaan asam, dekomposisi basa, dan reduksi langsung.[178][180] Kedua logam diproduksi sebagai produk sampingan dari produksi lithium: setelah tahun 1958, ketika minat terhadap sifat termonuklir lithium meningkat tajam, produksi rubidium dan cesium juga meningkat dengan sendirinya.[6]
Fransium-223, satu-satunya isotop alami fransium,[10][11] diproduksi secara alami sebagai hasil peluruhan alfa aktinium-227. Fransium dapat ditemukan dalam mineral uranium dan thorium dalam jumlah renik;[166] telah dihitung bahwa paling banyak ada 30 g fransium di kerak bumi pada waktu tertentu.[169] Akibat kelangkaannya di alam yang ekstrem, sebagian besar fransium disintesis dengan reaksi nuklir
menghasilkan fransium-209, fransium-210, dan fransium-211.[181] Jumlah terbesar fransium yang pernah dibuat sampai saat ini adalah sekitar 300.000 atom netral,[182] yang disintesis menggunakan reaksi nuklir tersebut di atas.[182]
Aplikasi
[sunting | sunting sumber]Lithium, natrium, dan kalium memiliki banyak aplikasi, sementara rubidium dan cesium sangat berguna dalam konteks akademis namun belum memiliki banyak aplikasi.[6] Lithium sering digunakan dalam baterai, dan lithium oksida dapat membantu proses silika. Lithium stearat adalah pengental dan dapat digunakan untuk membuat gemuk pelumas; ia dihasilkan dari litium hidroksida, yang juga digunakan untuk menyerap karbon dioksida dalam kapsul ruang angkasa dan kapal selam.[6] Lithium klorida digunakan sebagai paduan untuk mematri aluminium.[183] Lithium metalik digunakan dalam paduan dengan magnesium dan aluminium untuk menghasilkan paduan yang sangat keras dan ringan.[6]
Senyawa natrium memiliki banyak aplikasi, yang paling terkenal adalah garam dapur. Garam natrium dari asam lemak digunakan sebagai bahan pembuat sabun.[184] Natrium murni memiliki banyak aplikasi, termasuk digunakan dalam lampu uap natrium, yang menghasilkan cahaya yang sangat efisien dibandingkan dengan jenis penerangan lainnya,[185][186] dan bisa membantu menghaluskan permukaan logam lainnya.[187][188] Sebagai reduktor kuat, sering digunakan untuk mereduksi banyak logam lainnya, seperti titanium dan zirkonium, dari kloridanya.[6] Selain itu, natrium sangat berguna sebagai cairan penukar panas dalam reaktor nuklir pembiak cepat karena rendahnya titik lebur, viskositas, dan penampang absorpsi neutron.[6]
Senyawa kalium sering digunakan sebagai pupuk[6][189] karena kalium merupakan unsur penting bagi nutrisi tanaman. Kalium hidroksida adalah basa yang sangat kuat, dan digunakan untuk mengendalikan pH berbagai zat.[190][191] Kalium nitrat dan kalium permanganat sering digunakan sebagai oksidator kuat.[6] Kalium superoksida digunakan dalam masker pernapasan, karena bereaksi dengan karbon dioksida menghasilkan kalium karbonat dan gas oksigen. Logam kalium murni tidak banyak digunakan, tetapi paduannya dengan natrium dapat menggantikan natrium murni dalam reaktor nuklir pembiak cepat.[6]
Rubidium dan cesium sering digunakan dalam jam atom.[192] Jam atom cesium sangat akurat; jika jam dibuat pada zaman dinosaurus, ia akan meleset kurang dari empat detik setelah 80 juta tahun.[24] Oleh karena itu, atom cesium digunakan sebagai definisi detik.[193] Ion rubidium sering digunakan dalam warna ungu kembang api[194] sedangkan cesium sering digunakan dalam pengeboran cairan di industri perminyakan.[24][195]
Fransium tidak memiliki aplikasi komersial,[167][168][196] tetapi karena struktur atom franzium yang relatif sederhana, dibandingkan yang lain, ia digunakan dalam eksperimen spektroskopi, yang menghasilkan lebih banyak informasi mengenai tingkat energi dan tetapan coupling antara partikel subatomik.[197] Studi tentang cahaya yang dipancarkan oleh laser ion fransium-210 telah memberikan data akurat tentang transisi antara tingkat energi atom, serupa dengan yang diprediksi oleh teori kuantum.[198]
Peran biologis dan tindakan pencegahan
[sunting | sunting sumber]Logam
[sunting | sunting sumber]Logam alkali murni berbahaya karena reaktif dengan udara dan air dan harus dijauhkan dari panas, api, oksidator, asam, senyawa organik, halokarbon, plastik, dan kelembaban. Mereka juga bereaksi dengan karbon dioksida dan karbon tetraklorida, sehingga alat pemadam api normal menjadi kontraproduktif bila digunakan pada kebakaran logam alkali.[199] Beberapa pemadam bubuk kering Kelas D yang dirancang untuk kebakaran logam efektif mengurangi oksigen dari api dan mendinginkan logam alkali.[200]
Percobaan biasanya dilakukan dengan hanya menggunakan sejumlah kecil (beberapa gram) dalam sungkup asap. Sejumlah kecil lithium dapat dibuang dengan mereaksikannya dengan air dingin, tetapi logam alkali yang lebih berat harus dilarutkan dalam isopropanol yang kurang reaktif.[199][201] Logam alkali harus disimpan di dalam minyak mineral atau atmosfer inert. Atmosfer inert yang dapat digunakan adalah gas argon atau nitrogen, kecuali untuk lithium, yang bereaksi dengan nitrogen.[199] Rubidium dan cesium harus dijauhkan dari udara, bahkan di bawah minyak, karena sedikit saja udara yang berdifusi ke dalam minyak dapat memicu terbentuknya peroksida yang mudah meledak; untuk alasan yang sama, kalium tidak boleh disimpan di bawah minyak dalam atmosfer yang mengandung oksigen selama lebih dari 6 bulan.[202][203]
Ion
[sunting | sunting sumber]
Kimia bioanorganik ion logam alkali telah ditinjau secara ekstensif.[204] Struktur kristal fasa padat telah ditentukan untuk banyak kompleks ion logam alkali dalam peptida kecil, konstituen asam nukleat, karbohidrat dan kompleks ionofor.[205]
Lithium secara alami hanya terjadi dalam jumlah renik dalam sistem biologi dan tidak memiliki peran biologis yang diketahui, tetapi memang memiliki efek pada tubuh jika tertelan.[206] Lithium karbonat digunakan sebagai penstabil mood (bahasa Inggris: mood stabiliser) dalam psikiatri untuk mengobati gangguan bipolar (depresi manik) dalam dosis harian sekitar 0,5 sampai 2 gram, meski ada efek samping.[206] Konsumsi lithium berlebihan menyebabkan kantuk, cadel dan muntah, di antara gejala lain,[206] dan meracuni sistem saraf pusat,[206] ini berbahaya karena dosis lithium yang dibutuhkan untuk mengobati gangguan bipolar hanya sedikit lebih rendah dari dosis toksik.[206][207] Biokimianya, cara penanganannya oleh tubuh manusia dan penelitian yang menggunakan tikus dan kambing, menunjukkan bahwa itu adalah unsur renik esensial, walaupun fungsi biologi alami lithium pada manusia belum diidentifikasi.[208][209]
Natrium dan kalium terdapat pada semua sistem biologis yang diketahui, umumnya berfungsi sebagai elektrolit di dalam dan di luar sel.[210][211] Natrium adalah nutrisi penting yang mengatur volume darah, tekanan darah, kesetimbangan osmotik dan pH; persyaratan fisiologis minimum natrium adalah 500 mg per hari.[212] Natrium klorida (juga umum dikenal sebagai garam) adalah sumber utama natrium dalam makanan, dan digunakan sebagai bumbu dan pengawet, seperti untuk acar dan dendeng; sebagian besar berasal dari makanan olahan.[213] Referensi Asupan Harian untuk natrium adalah 1,5 gram per hari,[214] namun kebanyakan orang di Amerika Serikat mengkonsumsi lebih dari 2,3 gram per hari,[215] jumlah minimum yang memicu hipertensi;[216] hal yang menyebabkan 7,6 juta kematian dini di seluruh dunia.[217] Sementara itu, data dari Indonesian Society of Hypertension (INASH) menunjukkan asupan garam harian di Indonesia dapat mencapai angka 15 gram di atas jumlah yang direkomendasikan WHO (Organisasi Kesehatan Dunia).[218]
Kalium adalah kation (ion positif) utama di dalam sel hewan,[210] sementara natrium adalah kation utama di luar sel hewan.[210][211] Perbedaan konsentrasi dari partikel bermuatan ini menyebabkan perbedaan potensial listrik antara bagian dalam dan luar sel, yang dikenal sebagai potensial membran. Keseimbangan antara kalium dan natrium dipertahankan oleh protein pengangkut ion dalam membran sel.[219] Potensial membran sel yang diciptakan oleh ion kalium dan natrium memungkinkan sel menghasilkan potensial aksi—sebuah "lonjakan" pelepasan listrik. Kemampuan sel untuk menghasilkan debit listrik sangat penting untuk fungsi tubuh seperti neurotransmisi, kontraksi otot, dan fungsi jantung.[219] Gangguan terhadap keseimbangan ini dapat berakibat fatal: misalnya, konsumsi sejumlah besar senyawa kalium dapat menyebabkan hiperkalemia yang sangat mempengaruhi sistem kardiovaskular.[220][221] Kalium klorida digunakan di Amerika Serikat untuk eksekusi suntik mati (Euthanasia).[220]

Karena jari-jari atom mereka yang serupa, rubidium dan cesium dalam tubuh menyerupai kalium dan diserap dengan cara yang sama. Rubidium tidak memiliki peran biologis yang diketahui, tetapi dapat membantu merangsang metabolisme,[222][223][224] dan, seperti dengan cesium,[222][225] mengganti kalium dalam tubuh yang menyebabkan defisiensi kalium.[222][224] Substitusi parsial sangat mungkin dan kurang beracun: seseorang dengan berat badan 70 kg mengandung rata-rata 0,36 g rubidium, dan nilai ini ditingkatkan sebesar 50 sampai 100 kali tidak menunjukkan efek negatif pada orang yang diuji.[226] Tikus dapat bertahan hingga 50% substitusi kalium oleh rubidium.[227][228] Rubidium (dan pada tingkat yang lebih rendah cesium) dapat berfungsi sebagai obat sementara untuk hipokalemia; sementara rubidium cukup mampu secara fisiologis mengganti kalium dalam beberapa sistem, cesium tidak pernah mampu melakukannya.[223] Hanya ada bukti yang sangat terbatas berupa gejala defisiensi rubidium pada kambing; bahkan jika ini benar, jumlah renik yang biasanya ada dalam makanan lebih dari cukup.[229][230]
Senyawa cesium jarang ditemui oleh kebanyakan orang, tetapi sebagian besar senyawa cesium agak beracun. Seperti rubidium, cesium cenderung menggantikan kalium dalam tubuh, tetapi karena secara signifikan lebih besar maka cesium adalah pengganti yang lebih buruk.[225] Kelebihan cesium dapat menyebabkan hipokalemia, aritmia, dan serangan jantung akut,[231] namun jumlah tersebut biasanya tidak akan ditemui dalam sumber-sumber alami.[232] Dengan demikian, cesium bukanlah polutan lingkungan kimia utama.[233] Nilai dosis letal medium (LD50) untuk cesium klorida pada tikus adalah 2,3 g per kilogram, yang sebanding dengan nilai LD50 kalium klorida dan natrium klorida.[234] Cesium klorida telah dipromosikan sebagai terapi kanker alternatif,[235] namun telah dikaitkan dengan kematian lebih dari 50 pasien, yang digunakan sebagai bagian dari perawatan kanker yang tidak teruji secara ilmiah.[236]
Radioisotop cesium memerlukan tindakan pencegahan khusus: penanganan sinar gamma cesium-137 yang tidak tepat dapat menyebabkan pelepasan radioisotop dan cedera akibat radiasi. Mungkin kasus yang paling terkenal adalah kecelakaan Goiânia pada tahun 1987, di mana sistem terapi radiasi yang tidak dibuang dengan benar dari sebuah bekas klinik di kota Goiânia, Brasil, dipulung dari tempat barang rongsokan, dan garam cesium yang bercahaya dijual kepada pembeli yang penasaran, tetapi tidak berpendidikan. Hal ini menyebabkan empat kematian dan luka serius akibat paparan radiasi. Bersama-sama dengan cesium-134, iodium-131, dan strontium-90, caesium-137 termasuk di antara isotop yang disebarkan oleh bencana Chernobyl yang merupakan risiko terbesar terhadap kesehatan.[48] Radioisotop fransium mungkin berbahaya karena energi peluruhan yang tinggi dan waktu paruh yang pendek, tetapi tidak ada yang diproduksi dalam jumlah yang cukup besar untuk menimbulkan risiko serius.[237]
Lihat Juga
[sunting | sunting sumber]- Golongan tabel periodik
- Golongan 2 (IIA) (Logam alkali tanah)
- Golongan 3 (IIIB) (Logam tanah jarang)
- Golongan 4 (IVB)
- Golongan 5 (VB)
- Golongan 6 (VIB)
- Golongan 7 (VIIB)
- Golongan 8 (VIIIB)
- Golongan 9 (VIIIB)
- Golongan 10 (VIIIB)
- Golongan 11 (IB) (Logam koin)
- Golongan 12 (IIB) (Logam volatil)
- Golongan 13 (IIIA) (Ikosagen/Triel)
- Golongan 14 (IVA) (Kristalogen/Tetrel)
- Golongan 15 (VA) (Pniktogen/Pentel)
- Golongan 16 (VIA) (Kalkogen)
- Golongan 17 (VIIA) (Halogen)
- Golongan 18 (VIIIA) (Aerogen/Gas mulia)
Catatan
[sunting | sunting sumber]- ^ Simbol Na dan K masih digunakan juga di Rusia dan Jerman, selain di Indonesia. Bahasa Inggris menyebut sodium dan potassium untuk Na dan K
- ^ Caesium adalah ejaan yang direkomendasikan oleh International Union of Pure and Applied Chemistry (IUPAC).[1] American Chemical Society (ACS) telah menggunakan ejaan cesium sejak tahun 1921,[2][3] mengikuti Webster’s Third New International Dictionary.
- ^ Baik dalam IUPAC lama dan sistem CAS untuk penomoran golongan, golongan ini dikenal sebagai golongan IA (diucapkan sebagai "golongan satu A", karena huruf "I" adalah angka Romawi).[4]
- ^ Angka di dalam kurung menunjukkan ketidakpastian pengukuran. Ketidakpastian ini berlaku untuk angka bermakna terkecil (s) untuk angka yang mendahului nilai di dalam kurung (yaitu, dihitung dari digit paling kanan ke kiri). Misalnya, 1,00794(7) berarti 1,00794±0,00007, sementara 1,00794(72) berarti 1,00794±0,00072.[9]
- ^ Nilai tertera adalah nilai konvensional yang sesuai untuk perdagangan dan komersial; nilai sebenarnya berada pada kisaran antara 6,938 dan 6,997 tergantung pada komposisi isotop sampel.[11]
- ^ Unsur ini tidak memiliki nuklida stabil, dan angka di dalam kurung mengindikasikan nomor massa isotop unsur tersebut dengan umur terpanjang.[10][11]
- ^ a b Titik leleh fransium diklaim telah dikalkulasi sekitar 27 °C (81 °F; 300 K).[12] Namun, titik lelehnya tidak pasti karena sangat langkanya unsur ini serta radioaktivitasnya. Sehingga, perkiraan titik didihnya 677 °C (1.251 °F; 950 K) juga tidak pasti.
- ^ Nilai tercantum adalah untuk ion tetrakoordinasi, kecuali untuk Rb+ dan Cs+ yang merupakan nilai untuk ion heksakoordinasi.
- ^ Linus Pauling mengestimasi elektronegativitas fransium adalah 0,7 pada skala Pauling, sama seperti sesium;[17] nilai untuk sesium telah diperbarui menjadi 0,79, meskipun tidak ada data eksperimental yang menunjukkan pengaturan nilai fransium.[18] Fransium memiliki energi ionisasi sedikit lebih tinggi daripada sesium,[14] 392,811(4) kJ/mol dibandingkan dengan 375,7041(2) kJ/mol untuk sesium, seperti yang diperkirakan dari efek relativistik, dan ini membawa implikasi bahwa sesium kurang elektronegatif daripada fransium.
- ^ Dalam tabel periodik Mendeleev versi 1869, tembaga dan perak ditempatkan dalam golongan mereka masing-masing, selaras dengan hidrogen dan raksa, sementara emas ditempatkan tentatif di bawah uranium dan eka-aluminium yang belum ditemukan dalam golongan boron.
- ^ Asteris menandakan kondisi tereksitasi.
Referensi
[sunting | sunting sumber]- ^ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 248–49. Electronic version..
- ^ Coghill, Anne M.; Garson, Lorrin R., ed. (2006). The ACS Style Guide: Effective Communication of Scientific Information (edisi ke-3rd). Washington, D.C.: American Chemical Society. hlm. 127. ISBN 0-8412-3999-1..
- ^ Coplen, T. B.; Peiser, H. S. (1998). "History of the recommended atomic-weight values from 1882 to 1997: a comparison of differences from current values to the estimated uncertainties of earlier values" (PDF). Pure Appl. Chem. 70 (1): 237–257. doi:10.1351/pac199870010237..
- ^ Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. IUPAC. 60 (3): 431–436. doi:10.1351/pac198860030431. Diakses tanggal 24 March 2012.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae Royal Society of Chemistry. "Visual Elements: Group 1 – The Alkali Metals". Visual Elements. Royal Society of Chemistry. Diakses tanggal 13 January 2012.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ a b c Lide, D. R., ed. (2003). CRC Handbook of Chemistry and Physics (edisi ke-84th). Boca Raton, FL: CRC Press.
- ^ a b c d e f g h i j k l m n o p q Averill, Bruce A.; Eldredge, Patricia (2007). "21.3: The Alkali Metals". Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (edisi ke-1st). Prentice Hall. ISBN 9780805337990. Diakses tanggal 24 June 2013.
- ^ "Standard Uncertainty and Relative Standard Uncertainty". CODATA reference. National Institute of Standards and Technology. Diakses tanggal 26 September 2011.
- ^ a b c d Wieser, Michael E.; Berglund, Michael (2009). "Atomic weights of the elements 2007 (IUPAC Technical Report)" (PDF). Pure Appl. Chem. IUPAC. 81 (11): 2131–2156. doi:10.1351/PAC-REP-09-08-03. Diakses tanggal 7 February 2012.
- ^ a b c d e Wieser, Michael E.; Coplen, Tyler B. (2011). "Atomic weights of the elements 2009 (IUPAC Technical Report)" (PDF). Pure Appl. Chem. IUPAC. 83 (2): 359–396. doi:10.1351/PAC-REP-10-09-14. Diakses tanggal 11 February 2012.
- ^ "Francium". Los Alamos National Laboratory. 15 December 2003. Diakses tanggal 19 February 2012.
- ^ Klehr, Wolfram (21 May 2007). "Francium". apsidium.com. Diarsipkan dari versi asli tanggal 9 May 2008. Diakses tanggal 25 April 2012.
- ^ a b c Andreev, S.V.; Letokhov, V.S.; Mishin, V.I., (1987). "Laser resonance photoionization spectroscopy of Rydberg levels in Fr". Phys. Rev. Lett. 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. doi:10.1103/PhysRevLett.59.1274. PMID 10035190.
- ^ Landau, A.; Eliav, E.; Ishikawa, Y.; Kaldor, U. (2001). "Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119)". J. Chem. Phys. 115: 2389. doi:10.1063/1.1386413.
- ^ Jones, Cameron; Mountford, Philip; Stasch, Andreas; Blake, Matthew P. (22 June 2015). "s-block Metal-Metal Bonds". Dalam Liddle, Stephen T. Molecular Metal-Metal Bonds: Compounds, Synthesis, Properties. John Wiley and Sons. hlm. 23–24. ISBN 9783527335411.
- ^ Pauling, Linus (1960). The Nature of the Chemical Bond (edisi ke-Third). Cornell University Press. hlm. 93. ISBN 978-0-8014-0333-0.
- ^ Allred, A. L. (1961). "Electronegativity values from thermochemical data". J. Inorg. Nucl. Chem. 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5.
- ^ a b c d e f g h i j k l m n o p q r s Clark, Jim (2005). "Atomic and Physical Properties of the Group 1 Elements". chemguide. Diakses tanggal 30 January 2012.
- ^ Gray, Theodore. "Facts, pictures, stories about the element Cesium in the Periodic Table". The Wooden Periodic Table Table. Diakses tanggal 13 January 2012.
- ^ a b Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 0-313-33438-2.
- ^ The OpenLearn team (2012). "Alkali metals". OpenLearn. The Open University. Diakses tanggal 9 July 2012.
- ^ a b Gray, Theodore. "Alkali Metal Bangs". Theodore Gray. Diakses tanggal 13 May 2012.
- ^ a b c d Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). "Mineral Commodity Profile: Cesium" (PDF). United States Geological Survey. Diarsipkan (PDF) dari versi asli tanggal 22 November 2009. Diakses tanggal 27 December 2009.
- ^ J. L. Dye, J. M. Ceraso, Mei Lok Tak, B. L. Barnett, F. J. Tehan (1974). "Crystalline salt of the sodium anion (Na−)". J. Am. Chem. Soc. 96 (2): 608–609. doi:10.1021/ja00809a060.
- ^ F. J. Tehan, B. L. Barnett, J. L. Dye (1974). "Alkali anions. Preparation and crystal structure of a compound which contains the cryptated sodium cation and the sodium anion". J. Am. Chem. Soc. 96 (23): 7203–7208. doi:10.1021/ja00830a005.
- ^ J. L. Dye (1979). "Compounds of Alkali Metal Anions". Angew. Chem. Int. Ed. Engl. 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ M. Y. Redko, R. H. Huang, J. E. Jackson, J. F. Harrison, J. L. Dye (2003). "Barium azacryptand sodide, the first alkalide with an alkaline Earth cation, also contains a novel dimer, (Na2)2−". J. Am. Chem. Soc. 125 (8): 2259–2263. doi:10.1021/ja027241m. PMID 12590555.
- ^ a b c M. Y. Redko, M. Vlassa, J. E. Jackson, A. W. Misiolek, R. H. Huang RH, J. L. Dye (2002). ""Inverse sodium hydride": a crystalline salt that contains H+ and Na−". J. Am. Chem. Soc. 124 (21): 5928–5929. doi:10.1021/ja025655.
- ^ a b Agnieszka Sawicka, Piotr Skurski, and Jack Simons (2003). "Inverse Sodium Hydride: A Theoretical Study" (PDF). J. Am. Chem. Soc. 125 (13): 3954–3958. doi:10.1021/ja021136v. PMID 12656631.
- ^ Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. hlm. 20. ISBN 0-85312-027-7.
- ^ a b Richens, David. T. (1997). The Chemistry of Aqua Ions. Wiley. ISBN 0-471-97058-1.
- ^ Persson, Ingmar (2010). "Hydrated metal ions in aqueous solution: How regular are their structures?" (PDF). Pure Appl. Chem. 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22. Diakses tanggal 23 August 2014.
- ^ a b c d e Clark, Jim (2005). "Reaction of the Group 1 Elements with Oxygen and Chlorine". chemguide. Diakses tanggal 27 June 2012.
- ^ Shriver, Duward; Atkins, Peter (2006). Inorganic Chemistry. W. H. Freeman. hlm. 259. ISBN 978-0716748786. Diakses tanggal 10 November 2012.
- ^ a b c d e f g h i j k l m n o p q r s t u Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". Dalam Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (edisi ke-3rd). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1.
- ^ a b c d e Thayer, John S. (2010). "Relativistic Effects and the Chemistry of the Heavier Main Group Elements". Relativistic Methods for Chemists: 81, 84. doi:10.1007/978-1-4020-9975-5_2.
- ^ a b Various authors (2002). Lide, David R., ed. Handbook of Chemistry & Physics (edisi ke-88th). CRC. ISBN 0-8493-0486-5. OCLC 179976746. Diarsipkan dari versi asli tanggal 2017-07-24. Diakses tanggal 2008-05-23.
- ^ "Universal Nuclide Chart". Nucleonica. Institute for Transuranium Elements. 2007–2012. Diakses tanggal 2011-04-17.
- ^ a b c Sonzogni, Alejandro. "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Diarsipkan dari versi asli tanggal 2018-10-10. Diakses tanggal 4 October 2012.
- ^ Patton, I. Jocelyn; Waldbauer, L. J. (1926). "The Radioactivity of the Alkali Metals". Chemical Reviews. 3: 81–93. doi:10.1021/cr60009a003.
- ^ McLennan, J. C.; Kennedy, W. T. (1908). "On the radioactivity of potassium and other alkali metals". Philosophical Magazine. 6. 16 (93): 377–395. doi:10.1080/14786440908636519.
- ^ "Potassium-40" (PDF). Human Health Fact Sheet. Argonne National Laboratory, Environmental Science Division. August 2005. Diarsipkan dari versi asli (PDF) tanggal 2012-03-07. Diakses tanggal 7 February 2012.
- ^ a b Fontani, Marco (10 September 2005). "The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do)". International Conference on the History of Chemistry. Lisbon. hlm. 1–8. Diarsipkan dari versi asli tanggal 24 February 2006. Diakses tanggal 8 April 2007.
- ^ a b Van der Krogt, Peter (10 January 2006). "Francium". Elementymology & Elements Multidict. Diakses tanggal 8 April 2007.
- ^ National Institute of Standards and Technology. "Radionuclide Half-Life Measurements". Diarsipkan dari versi asli tanggal 2016-08-12. Diakses tanggal 2011-11-07.
- ^ "Radioisotope Brief: Cesium-137 (Cs-137)", Radiation Emergencies, Centers for Disease Control and Prevention, October 16, 2014, diarsipkan dari versi asli tanggal 2016-03-29, diakses tanggal 31 Maret 2016
- ^ a b The Radiological Accident in Goiânia. IAEA. 1988.
- ^ L. Brown, Theodore; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Burdge, Julia R. (2003). Chemistry: The Central Science (edisi ke-8th). US: Pearson Education. ISBN 0-13-061142-5. Diarsipkan dari versi asli tanggal 2011-07-24. Diakses tanggal 2017-05-13.
- ^ a b Clark, Jim (2005). "Reaction of the Group 1 Elements with Water". chemguide. Diakses tanggal 18 June 2012.
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "Electronegativity".
- ^ David. E. Goldberg (1988). 3,000 Solved Problems in Chemistry (edisi ke-1st). McGraw-Hill. ISBN 0-07-023684-4. Section 17.43, page 321
- ^ Louis Theodore, R. Ryan Dupont and Kumar Ganesan (Editors) (1999). Pollution Prevention: The Waste Management Approach to the 21st Century. CRC Press. ISBN 1-56670-495-2. Section 27, p. 15
- ^ a b Clark, Jim (2000). "Metallic Bonding". chemguide. Diakses tanggal 23 March 2012.
- ^ "Coulomb explosion during the early stages of the reaction of alkali metals with water". Nature Chemistry. 26 Jan 2015. doi:10.1038/nchem.2161.
- ^ Buszek, Keith R. (2001) "Sodium Amalgam" in Encyclopedia of Reagents for Organic Synthesis, Wiley. doi:10.1002/047084289X.rs040
- ^ "Sodium-Potassium Alloy (NaK)" (PDF). BASF.
- ^ Kaner, Richard (2003). "Cesium". Chemical and Engineering News.
- ^ Sevov, S.C. "Zintl Phases", pp. 113–132 in Intermetallic Compounds, Principles and Practice: Progress, Vol. 3. Westbrook, J.H.; Freisher, R.L.: Eds.; John Wiley & Sons. Ltd., Chichester, England doi:10.1002/0470845856 ISBN 9780470845851
- ^ a b Kauzlarich, S.M. (1994), Encyclopedia of Inorganic Chemistry, John Wiley & Sons, ISBN 0-471-93620-0
- ^ Hagen, A. P. (17 September 2009). Inorganic Reactions and Methods, The Formation of Bonds to Group-I, -II, and -IIIB Elements. John Wiley & Sons. hlm. 204–5. ISBN 9780470145494.
- ^ Matkovich, V. I. (6 December 2012). Boron and Refractory Borides. Springer. hlm. 262–92. ISBN 9783642666209.
- ^ Hermann, Andreas; McSorley, Alexandra; N. W., Ashcroft; Hoffmann, Roald (2012). "From Wade–Mingos to Zintl–Klemm at 100 GPa: Binary Compounds of Boron and Lithium" (PDF). Journal of the American Chemical Society. 2012 (134): 18606–18. doi:10.1021/ja308492g. Diarsipkan dari versi asli (PDF) tanggal 2020-09-27. Diakses tanggal 21 August 2016.
- ^ Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 14: The group 14 elements". Inorganic Chemistry, 3rd Edition. Pearson. hlm. 386. ISBN 978-0-13-175553-6.
- ^ "NIST Ionizing Radiation Division 2001 - Technical Highlights". Diarsipkan dari versi asli tanggal 2006-10-06. Diakses tanggal 2017-05-13.
- ^ N. Emery; et al. (2008). "Review: Synthesis and superconducting properties of CaC6". Sci. Technol. Adv. Mater. 9 (4): 044102. Bibcode:2008STAdM...9d4102E. doi:10.1088/1468-6996/9/4/044102.
- ^ Hoch, Constantin; Wendorff, Marco; Röhr, Caroline (2002). "Tetrapotassium nonastannide, K4Sn9". Acta Crystallographica Section C Crystal Structure Communications. 58 (4): i45. doi:10.1107/S0108270102002032.
- ^ Duncan H. Gregory, Paul M. O'Meara, Alexandra G. Gordon, Jason P. Hodges, Simine Short, and James D. Jorgensen (2002). "Structure of Lithium Nitride and Transition-Metal-Doped Derivatives, Li3−x−yMxN (M = Ni, Cu): A Powder Neutron Diffraction Study". Chem. Mater. 14 (5): 2063–2070. doi:10.1021/cm010718t.
- ^ Fischer, D., Jansen, M. (2002). "Synthesis and structure of Na3N". Angew Chem. 41 (10): 1755–1756. doi:10.1002/1521-3773(20020517)41:10<1755::AID-ANIE1755>3.0.CO;2-C.
- ^ Fischer, D.; Cancarevic, Z.; Schön, J. C.; Jansen, M. Z. (2004). "Synthesis and structure of K3N". Z. anorg allgem Chemie. 630 (1): 156–160. doi:10.1002/zaac.200300280.. 'Elusive Binary Compound Prepared' Chemical & Engineering News 80 No. 20 (20 May 2002)
- ^ H.G. Von Schnering, W. Hönle (1994), "Phosphides - Solid-state Chemistry", dalam R. Bruce King, Encyclopedia of Inorganic Chemistry, John Wiley & Sons, ISBN 0-471-93620-0
- ^ Kahlenberg, Louis (2008). Outlines of Chemistry – A Textbook for College Students. READ BOOKS. hlm. 324–325. ISBN 1-4097-6995-X.
- ^ "Welcome to Arthur Mar's Research Group". University of Alberta. University of Alberta. 1999–2013. Diakses tanggal 24 June 2013.
- ^ Lindsay, D. M.; Garland, D. A. (1987). "ESR spectra of matrix-isolated lithium superoxide". The Journal of Physical Chemistry. 91 (24): 6158–61. doi:10.1021/j100308a020.
- ^ Vol'nov, I. I.; Matveev, V. V. (1963). "Synthesis of cesium ozonide through cesium superoxide". Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ^ Tokareva, S. A. (1971). "Alkali and Alkaline Earth Metal Ozonides". Russian Chemical Reviews. 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ^ Simon, A. (1997). "Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels". Coordination Chemistry Reviews. 163: 253–270. doi:10.1016/S0010-8545(97)00013-1.
- ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). "The Crystal Structure of Tricesium Monoxide". Journal of Physical Chemistry. 60 (3): 345–347. doi:10.1021/j150537a023.
- ^ Okamoto, H. (2009). "Cs-O (Cesium-Oxygen)". Journal of Phase Equilibria and Diffusion. 31: 86–87. doi:10.1007/s11669-009-9636-5.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004). "Characterization of Oxides of Cesium". The Journal of Physical Chemistry B. 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ^ Brauer, G. (1947). "Untersuchungen ber das System Cäsium-Sauerstoff". Zeitschrift für anorganische Chemie. 255: 101–124. doi:10.1002/zaac.19472550110.
- ^ Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). "Mineral Commodity Profile: Cesium" (PDF). United States Geological Survey. Diakses tanggal 27 December 2009.
- ^ House, James E. (2008). Inorganic chemistry. Academic Press. hlm. 524. ISBN 0-12-356786-6.
- ^ Moyer, Harvey V. (1956). "Chemical Properties of Polonium". Dalam Moyer, Harvey V. Polonium. Oak Ridge, Tenn.: United States Atomic Energy Commission. hlm. 33–96. doi:10.2172/4367751. TID-5221.
- ^ Bagnall, K. W. (1962). "The Chemistry of Polonium". Adv. Inorg. Chem. Radiochem. Advances in Inorganic Chemistry and Radiochemistry. 4: 197–229. doi:10.1016/S0065-2792(08)60268-X. ISBN 978-0-12-023604-6.
- ^ Alberto, R.; Ortner, K.; Wheatley, N.; Schibli, R.; Schubiger, A. P. (2001). "Synthesis and properties of boranocarbonate: a convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3]+". J. Am. Chem. Soc. 121 (13): 3135–3136. doi:10.1021/ja003932b.
- ^ Cotton, F.A.; Wilkinson, G. (1972). Advanced Inorganic Chemistry. John Wiley and Sons Inc. ISBN 0-471-17560-9.
- ^ Brown, T. L.; Rogers, M. T. (1957). "The Preparation and Properties of Crystalline Lithium Alkyls". Journal of the American Chemical Society. 79 (8): 1859–1861. doi:10.1021/ja01565a024.
- ^ Manfred Schlosser (1988). "Superbases for organic synthesis". Pure and Appl. Chem. 60 (11): 1627–1634. doi:10.1351/pac198860111627.
- ^ Clegg, William; Conway, Ben; Kennedy, Alan R.; Klett, Jan; Mulvey, Robert E.; Russo, Luca (2011). "Synthesis and Structures of \(Trimethylsilyl)methyl]sodium and -potassium with Bi- and Tridentate N-Donor Ligands". European Journal of Inorganic Chemistry. 2011 (5): 721–726. doi:10.1002/ejic.201000983.
- ^ a b c d Pyykkö, Pekka (2011). "A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions". Physical Chemistry Chemical Physics. 13 (1): 161–8. Bibcode:2011PCCP...13..161P. doi:10.1039/c0cp01575j. PMID 20967377.
- ^ a b c Seaborg, G. T. (c. 2006). "transuranium element (chemical element)". Encyclopædia Britannica. Diakses tanggal 16 March 2010.
- ^ Gäggeler, Heinz W. (5–7 November 2007). "Gas Phase Chemistry of Superheavy Elements" (PDF). Lecture Course Texas A&M. Diarsipkan dari versi asli (PDF) tanggal 2012-02-20. Diakses tanggal 26 February 2012.
- ^ Fricke, Burkhard (1975). "Superheavy elements: a prediction of their chemical and physical properties". Recent Impact of Physics on Inorganic Chemistry. 21: 89–144. doi:10.1007/BFb0116498. Diakses tanggal 4 October 2013.
- ^ Kratz, J. V. (5 September 2011). The Impact of Superheavy Elements on the Chemical and Physical Sciences (PDF). 4th International Conference on the Chemistry and Physics of the Transactinide Elements. Diakses tanggal 27 August 2013.
- ^ "Nuclear scientists eye future landfall on a second 'island of stability'", eurekalert.org
- ^ Jens Grumann, Ulrich Mosel, Bernd Fink, Walter Greiner (1969), "Investigation of the Stability of Superheavy Nuclei around Z=114 and Z=164*", Z.Physik, 228: 371–386, diarsipkan dari versi asli tanggal 2013-09-29, diakses tanggal 2017-05-13
- ^ a b "International Union of Pure and Applied Chemistry > Periodic Table of the Elements". IUPAC. Diakses tanggal 1 May 2011.
- ^ Folden, Cody (31 January 2009). "The Heaviest Elements in the Universe" (PDF). Saturday Morning Physics at Texas A&M. Diakses tanggal 9 March 2012.
- ^ Emsley, J. (1989). The Elements. Oxford: Clarendon Press. hlm. 22–23.
- ^ Mark J. Winter (1994), Chemical Bonding, Oxford University Press, ISBN 0-19-855694-2
- ^ a b c d e f Vinson, Greg (2008). "Hydrogen is a Halogen". HydrogenTwo.com. Diarsipkan dari versi asli tanggal 2012-01-10. Diakses tanggal 14 January 2012.
- ^ a b c d e f Cronyn, Marshall W. (August 2003). "The Proper Place for Hydrogen in the Periodic Table" (PDF). Journal of Chemical Education. 80 (8): 947–951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ^ J.E. Huheey, E.A. Keiter, and R.L. Keiter (1993), Inorganic Chemistry : Principles of Structure and Reactivity (edisi ke-4th), HarperCollins, New York, USA
- ^ A.M. James and M.P. Lord (1992), Macmillan's Chemical and Physical Data, Macmillan, London, UK
- ^ Wigner, E.; Huntington, H.B. (1935). "On the possibility of a metallic modification of hydrogen". Journal of Chemical Physics. 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590.
- ^ Nellis, W. J.; Weir, S. T.; Mitchell, A. C. (1999). "Metallization of fluid hydrogen at 140 GPa (1.4 Mbar) by shock compression". Shock Waves. 9: 301–305. Bibcode:1999ShWav...9..301N. doi:10.1007/s001930050189.
- ^ Cousins, David M.; Davidson, Matthew G.; García-Vivó, Daniel (2013). "Unprecedented participation of a four-coordinate hydrogen atom in the cubane core of lithium and sodium phenolates". Chem. Commun. 49: 11809–11811. doi:10.1039/c3cc47393g. Diakses tanggal 7 August 2014.
- ^ Mark R. Leach. "2002 Inorganic Chemist's Periodic Table". Diakses tanggal 16 October 2012.
- ^ Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ^ a b c Stevenson, D. J. (20 November 1975). "Does metallic ammonium exist?". Nature. Nature Publishing Group. 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. Diakses tanggal 13 January 2012.
- ^ a b Bernal, M. J. M.; Massey, H. S. W. (3 February 1954). "Metallic Ammonium" (PDF). Monthly Notices of the Royal Astronomical Society. Wiley-Blackwell for the Royal Astronomical Society. 114: 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172.
- ^ "Solubility Rules!". Diakses tanggal 4 January 2014.
- ^ R. D. Shannon (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ a b Crookes, William (1864). "On Thallium". The Journal of the Chemical Society, London. Harrison & Sons. 17: 112–152. doi:10.1039/js8641700112. Diakses tanggal 13 January 2012.
- ^ a b c d Leach, Mark R. (1999–2012). "The Internet Database of Periodic Tables". meta-synthesis.com. Diakses tanggal 6 April 2012.
- ^ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 51. Electronic version..
- ^ Anja-Verena Mudring (2007). "Thallium Halides - New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements". European Journal of Inorganic Chemistry. 2007 (6): 882–890. doi:10.1002/ejic.200600975.
- ^ Russell AM & Lee KL (2005), Structure-property relations in nonferrous metals, Wiley-Interscience, New York, hlm. 302, ISBN 047164952X
- ^ Deming HG (1940), Fundamental Chemistry, John Wiley & Sons, New York, hlm. 705–7
- ^ a b c d e Jensen, William B. (2003). "The Place of Zinc, Cadmium, and Mercury in the Periodic Table" (PDF). Journal of Chemical Education. American Chemical Society. 80 (8): 952–961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. Diarsipkan dari versi asli (PDF) tanggal 11 June 2010. Diakses tanggal 2012-05-06.
- ^ "Salary". Diakses tanggal 20 July 2015.
- ^ Marggraf, Andreas Siegmund (1761). Chymische Schriften. hlm. 167.
- ^ du Monceau, H. L. D. "Sur la Base de Sel Marine". Memoires de l'Academie royale des Sciences (dalam bahasa French): 65–68.
- ^ a b Weeks, Mary Elvira (1932). "The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium". Journal of Chemical Education. 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ^ a b Siegfried, R. (1963). "The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements". Isis. 54 (2): 247–258. doi:10.1086/349704. JSTOR 228541.
- ^ Enghag, P. (2004). "11. Sodium and Potassium". Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 3-527-30666-8.
- ^ a b Davy, Humphry (1808). "On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies". Philosophical Transactions of the Royal Society of London. 98: 1–44. doi:10.1098/rstl.1808.0001.
- ^ Shaposhnik, V. A. (2007). "History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)". Journal of Analytical Chemistry. 62 (11): 1100–1102. doi:10.1134/S1061934807110160.
- ^ Ralph, Jolyon; Chau, Ida (24 August 2011). "Petalite: Petalite mineral information and data". Diakses tanggal 27 November 2011.
- ^ a b Winter, Mark. "WebElements Periodic Table of the Elements | Lithium | historical information". Diakses tanggal 27 November 2011.
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. hlm. 124. ISBN 0-7661-3872-0. Diakses tanggal 10 August 2009.
- ^ "Johan Arfwedson". Diarsipkan dari versi asli tanggal 5 June 2008. Diakses tanggal 10 August 2009.
- ^ a b van der Krogt, Peter. "Lithium". Elementymology & Elements Multidict. Diarsipkan dari versi asli tanggal 2011-06-16. Diakses tanggal 5 October 2010.
- ^ Clark, Jim (2005). "Compounds of the Group 1 Elements". chemguide. Diakses tanggal 10 August 2009.
- ^ Kaner, Richard (2003). "C&EN: It's Elemental: The Periodic Table – Cesium". American Chemical Society. Diakses tanggal 25 February 2010.
- ^ Kirchhoff, G.; Bunsen, R. (1861). "Chemische Analyse durch Spectralbeobachtungen". Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. XIII. Some spectroscopic discoveries". Journal of Chemical Education. 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ^ Oxford English Dictionary, 2nd Edition
- ^ Newlands, John A. R. (20 August 1864). "On Relations Among the Equivalents". Chemical News. 10: 94–95. Diarsipkan dari versi asli tanggal 1 January 2011. Diakses tanggal November 25, 2013.
- ^ Newlands, John A. R. (18 August 1865). "On the Law of Octaves". Chemical News. 12: 83. Diarsipkan dari versi asli tanggal 1 January 2011. Diakses tanggal November 25, 2013.
- ^ Mendelejew, Dimitri (1869). "Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente". Zeitschrift für Chemie (dalam bahasa German): 405–406.
- ^ Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. IUPAC. 60 (3): 431–436. doi:10.1351/pac198860030431. Diakses tanggal November 25, 2013.
- ^ "Alabamine & Virginium". TIME. 15 February 1932. Diarsipkan dari versi asli tanggal 2011-01-30. Diakses tanggal 1 April 2007.
- ^ MacPherson, H. G. (1934). "An Investigation of the Magneto-Optic Method of Chemical Analysis". Physical Review. American Physical Society. 47 (4): 310–315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- ^ Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25), "Francium (Atomic Number 87), the Last Discovered Natural Element", The Chemical Educator (edisi ke-5), vol. 10, diarsipkan dari versi asli tanggal 2013-06-04, diakses tanggal 2017-05-13
- ^ "Francium". McGraw-Hill Encyclopedia of Science & Technology. 7. McGraw-Hill Professional. 2002. hlm. 493–494. ISBN 0-07-913665-6.
- ^ a b Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M.; Moody, K. J.; Gregorich, K. E.; Seaborg, G. (1985). "Search for superheavy elements using 48Ca + 254Esg reaction". Physical Review C. 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760.
- ^ van der Krogt, Peter. "Ununennium". Elementymology & Elements Multidict. Diakses tanggal 14 February 2011.
- ^ Schadel, M.; Brüchle, W.; Brügger, M.; Gäggeler, H.; Moody, K.; Schardt, D.; Sümmerer, K.; Hulet, E.; Dougan, A.; et al. (1986). "Heavy isotope production by multinucleon transfer reactions with 254Es". Journal of the Less Common Metals. 122: 411–417. doi:10.1016/0022-5088(86)90435-2.
- ^ "Modern alchemy: Turning a line". The Economist. 12 May 2012. Diakses tanggal 5 October 2012.
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (edisi ke-New). New York, NY: Oxford University Press. hlm. 593. ISBN 978-0-19-960563-7.
- ^ a b Lodders, Katharina (2003). "Solar System Abundances and Condensation Temperatures of the Elements". The Astrophysical Journal. 591 (2): 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492.
- ^ Oddo, Giuseppe (1914). "Die Molekularstruktur der radioaktiven Atome". Zeitschrift für anorganische Chemie. 87: 253–268. doi:10.1002/zaac.19140870118.
- ^ Harkins, William D. (1917). "The Evolution of the Elements and the Stability of Complex Atoms. I. A New Periodic System Which Shows a Relation Between the Abundance of the Elements and the Structure of the Nuclei of Atoms". Journal of the American Chemical Society. 39 (5): 856–879. doi:10.1021/ja02250a002.
- ^ North, John (2008). Cosmos an illustrated history of astronomy and cosmology (edisi ke-Rev. and updated). Univ. of Chicago Press. hlm. 602. ISBN 978-0-226-59441-5.
- ^ Morgan, J. W.; Anders, E. (1980). "Chemical composition of Earth, Venus, and Mercury". Proceedings of the National Academy of Sciences. 77 (12): 6973–6977. Bibcode:1980PNAS...77.6973M. doi:10.1073/pnas.77.12.6973. PMC 350422
 . PMID 16592930.
. PMID 16592930.
- ^ Albarède, Francis (2003). Geochemistry: an introduction. Cambridge University Press. ISBN 978-0-521-89148-6.
- ^ "Abundance in Earth's Crust". WebElements.com. Diakses tanggal 14 April 2007.
- ^ "List of Periodic Table Elements Sorted by Abundance in Earth's crust". Israel Science and Technology Homepage. Diakses tanggal 15 April 2007.
- ^ a b c Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ "Lithium Occurrence". Institute of Ocean Energy, Saga University, Japan. Diarsipkan dari versi asli tanggal 2009-05-02. Diakses tanggal 13 March 2009.
- ^ "Some Facts about Lithium". ENC Labs. Diarsipkan dari versi asli tanggal 2011-07-10. Diakses tanggal 15 October 2010.
- ^ Schwochau, Klaus (1984). "Extraction of metals from sea water". Topics in Current Chemistry. Topics in Current Chemistry. 124/1984: 91–133. doi:10.1007/3-540-13534-0_3. ISBN 978-3-540-13534-0.
- ^ Wise, M. A. (1995). "Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites". Mineralogy and Petrology. 55 (13): 203–215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588.
- ^ a b CRC Handbook of Chemistry and Physics. 4. CRC. 2006. hlm. 12. ISBN 0-8493-0474-1.
- ^ a b c Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. hlm. 151–153. ISBN 0-19-850341-5.
- ^ a b Gagnon, Steve. "Francium". Jefferson Science Associates, LLC. Diarsipkan dari versi asli tanggal 31 March 2007. Diakses tanggal 1 April 2007.
- ^ a b Winter, Mark. "Geological information". Francium. The University of Sheffield. Diakses tanggal 26 March 2007.
- ^ "It's Elemental — The Periodic Table of Elements". Jefferson Lab. Diarsipkan dari versi asli tanggal 29 April 2007. Diakses tanggal 14 April 2007.
- ^ Ober, Joyce A. "Lithium" (PDF). United States Geological Survey. hlm. 77–78. Diarsipkan (PDF) dari versi asli tanggal 11 July 2007. Diakses tanggal 19 August 2007.
- ^ Pauling, Linus (1988). General Chemistry (edisi ke-1970). Dover Publications.
- ^ "Los Alamos National Laboratory – Sodium". Diakses tanggal 8 June 2007.
- ^ Merck Index, 9th ed., monograph 8325
- ^ Winter, Mark. "WebElements Periodic Table of the Elements | Potassium | Essential information". Webelements. Diakses tanggal 27 November 2011.
- ^ Lemke, Charles H.; Markant, Vernon H. (2001). "Sodium and Sodium Alloys". Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1915040912051311.a01.pub2. ISBN 0471238961.
- ^ "Cesium and Rubidium Hit Market". Chemical & Engineering News. 37 (22): 50–56. 1959. doi:10.1021/cen-v037n022.p050.
- ^ a b c d Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2003). "Mineral Commodity Profile: Rubidium" (PDF). United States Geological Survey. Diakses tanggal 4 December 2010.
- ^ bulletin 585. United States. Bureau of Mines. 1995.
- ^ Burt, R. O. (1993). "Caesium and cesium compounds". Kirk-Othmer encyclopedia of chemical technology. 5 (edisi ke-4th). New York: John Wiley & Sons, Inc. hlm. 749–764. ISBN 978-0-471-48494-3.
- ^ Stancari, G.; Veronesi, S.; Corradi, L.; Atutov, S. N.; Calabrese, R.; Dainelli, A.; Mariotti, E.; Moi, L.; Sanguinetti, S.; Tomassetti, L. (2006). "Production of Radioactive Beams of Francium". Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 557 (2): 390–396. Bibcode:2006NIMPA.557..390S. doi:10.1016/j.nima.2005.11.193.
- ^ a b Orozco, Luis A. (2003), "Francium", Chemical and Engineering News
- ^ USGS (2011). "Lithium" (PDF). Diakses tanggal 4 December 2011.
- ^ "Soaps & Detergents: Chemistry". Diakses tanggal 20 July 2015.
- ^ Lindsey, Jack L (1997). Applied illumination engineering. hlm. 112. ISBN 978-0-88173-212-2.
- ^ Kane, Raymond; Sell, Heinz (2001). Revolution in lamps: A chronicle of 50 years of progress. hlm. 241. ISBN 978-0-88173-351-8.
- ^ Stampers, National Association of Drop Forgers and (1957). Metal treatment and drop forging.
- ^ Harris, Jay C (1949). Metal cleaning bibliographical abstracts. hlm. 76.
- ^ Cordel, Oskar (1868). Die Stassfurter Kalisalze in der Landwirthschalt: Eine Besprechung ... (dalam bahasa German). L. Schnock. Diakses tanggal 29 May 2011.
- ^ Toedt, John; Koza, Darrell; Cleef-Toedt, Kathleen Van (2005). "Personal Cleansing Products: Bar Soap". Chemical composition of everyday products. Greenwood Publishing Group. ISBN 978-0-313-32579-3.
- ^ Schultz, H.; et al. (2006). "Potassium compounds". Ullmann's Encyclopedia of Industrial Chemistry. A22. hlm. 95. doi:10.1002/14356007.a22_031.pub2. ISBN 3-527-30673-0.
- ^ "Cesium Atoms at Work". Time Service Department—U.S. Naval Observatory—Department of the Navy. Diarsipkan dari versi asli tanggal 2015-02-23. Diakses tanggal 20 December 2009.
- ^ "The NIST reference on Constants, Units, and Uncertainty". National Institute of Standards and Technology.
- ^ Koch, E.-C. (2002). "Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics". Journal Pyrotechnics. 15: 9–24. Diarsipkan dari versi asli tanggal 2011-07-13. Diakses tanggal 2017-05-13.
- ^ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. McGraw-Hill. hlm. 201–203. ISBN 0-8306-3015-5.
- ^ Winter, Mark. "Uses". Francium. The University of Sheffield. Diarsipkan dari versi asli tanggal 31 March 2007. Diakses tanggal 25 March 2007.
- ^ Gomez, E; Orozco, L A; Sprouse, G D (7 November 2005). "Spectroscopy with trapped francium: advances and perspectives for weak interaction studies". Rep. Prog. Phys. 69 (1): 79–118. Bibcode:2006RPPh...69...79G. doi:10.1088/0034-4885/69/1/R02.
- ^ Peterson, I (11 May 1996). "Creating, cooling, trapping francium atoms" (PDF). Science News. 149 (19): 294. doi:10.2307/3979560. Diarsipkan dari versi asli (PDF) tanggal 2011-06-04. Diakses tanggal 11 September 2009.
- ^ a b c Lerner, Michael M. (2013). "Standard Operating Procedure: Storage and Handling of Alkali Metals". Oregon State University. Diakses tanggal 26 August 2016.
- ^ Solomon, Robert E. (2002). Fire and Life Safety Inspection Manual. Jones & Bartlett Learning. hlm. 459. ISBN 978-0-87765-472-8.
- ^ Angelici, R. J. (1999). Synthesis and Technique in Inorganic Chemistry. Mill Valley, CA: University Science Books. ISBN 0-935702-48-2.
- ^ Martel, Bernard; Cassidy, Keith (2004-07-01). "Rubidium". Chemical risk analysis: a practical handbook. hlm. 215. ISBN 978-1-903996-65-2.
- ^ Wray, Thomas K. "Danger: peroxidazable chemicals" (PDF). Environmental Health & Public Safety (North Carolina State University). Diarsipkan dari versi asli (PDF) tanggal 2011-06-08. Diakses tanggal 2017-05-13.
- ^ Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel, ed. (2016). The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. 16. Springer. doi:10.1007/978-3-319-21756-7.
- ^ Katsuyuki, Aoki; Kazutaka, Murayama; Hu, Ning-Hai (2016). "Chapter 3. Solid State Structuresof Alkali Metal Ion Complexes Formed by Low-Molecular-Weight Ligands of Biological Relevance". Dalam Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel. The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. 16. Springer. hlm. 27–101. doi:10.1007/978-3-319-21756-7_3.
- ^ a b c d e Winter, Mark. "WebElements Periodic Table of the Elements | Lithium | biological information". Webelements. Diakses tanggal 15 February 2011.
- ^ Gray, Theodore. "Facts, pictures, stories about the element Lithium in the Periodic Table". theodoregray.com. Diakses tanggal 9 January 2012.
- ^ Howland, Robert H. (September 2007). "Lithium: Underappreciated and Underused?". Psychiatric Annals. 37 (9). Diakses tanggal 6 November 2012.
- ^ Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael (August 2011). "Low-dose lithium uptake promotes longevity in humans and metazoans". European Journal of Nutrition. 50 (5): 387–9. doi:10.1007/s00394-011-0171-x. PMC 3151375
 . PMID 21301855.
. PMID 21301855.
- ^ a b c Winter, Mark. "WebElements Periodic Table of the Elements | Potassium | biological information". WebElements. Diakses tanggal 13 January 2012.
- ^ a b Winter, Mark. "WebElements Periodic Table of the Elements | Sodium | biological information". WebElements. Diakses tanggal 13 January 2012.
- ^ "Sodium" (PDF). Northewestern University. Diarsipkan dari versi asli (PDF) tanggal 23 August 2011. Diakses tanggal 21 November 2011.
- ^ "Sodium and Potassium Quick Health Facts". Diakses tanggal 7 November 2011.
- ^ "Dietary Reference Intakes: Water, Potassium, Sodium, Chloride, and Sulfate". Food and Nutrition Board, Institute of Medicine, United States National Academies. 11 February 2004. Diarsipkan dari versi asli tanggal 2011-10-06. Diakses tanggal 23 November 2011.
- ^ U.S. Department of Agriculture; U.S. Department of Health and Human Services (December 2010). Dietary Guidelines for Americans, 2010 (PDF) (edisi ke-7th). hlm. 22. ISBN 978-0-16-087941-8. OCLC 738512922. Diarsipkan dari versi asli (PDF) tanggal 2011-10-27. Diakses tanggal 23 November 2011.
- ^ Geleijnse, J. M.; Kok, F. J.; Grobbee, D. E. (2004). "Impact of dietary and lifestyle factors on the prevalence of hypertension in Western populations". European Journal of Public Health. 14 (3): 235–239. doi:10.1093/eurpub/14.3.235
 . PMID 15369026.
. PMID 15369026.
- ^ Lawes, C. M.; Vander Hoorn, S.; Rodgers, A.; International Society of Hypertension (2008). "Global burden of blood-pressure-related disease, 2001" (PDF). Lancet. 371 (9623): 1513–1518. doi:10.1016/S0140-6736(08)60655-8. PMID 18456100. Diarsipkan dari versi asli (PDF) tanggal 28 January 2012.
- ^ "Konsumsi Garam Harian di Indonesia 15 gram Lebih Tinggi", republika.co.id, 2013-10-06, diakses tanggal 2017-05-13
- ^ a b Mikko Hellgren; Lars Sandberg; Olle Edholm (2006). "A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study". Biophys. Chem. 120 (1): 1–9. doi:10.1016/j.bpc.2005.10.002. PMID 16253415.
- ^ a b Schonwald, Seth (2004). "Potassium Chloride and Potassium Permanganate". Medical toxicology. Lippincott Williams & Wilkins. hlm. 903–5. ISBN 978-0-7817-2845-4.
- ^ Markovchick, Vincent J. & Pons, Peter T. (2003). Emergency medicine secrets. Elsevier Health Sciences. hlm. 223. ISBN 978-1-56053-503-4.
- ^ a b c Winter, Mark. "WebElements Periodic Table of the Elements | Rubidium | biological information". Webelements. Diakses tanggal 15 February 2011.
- ^ a b Relman, A. S. (1956). "The Physiological Behavior of Rubidium and Cesium in Relation to That of Potassium". The Yale Journal of Biology and Medicine. 29 (3): 248–62. PMC 2603856
 . PMID 13409924.
. PMID 13409924.
- ^ a b Meltzer, H. L. (1991). "A pharmacokinetic analysis of long-term administration of rubidium chloride". Journal of clinical pharmacology. 31 (2): 179–84. doi:10.1002/j.1552-4604.1991.tb03704.x. PMID 2010564. Diarsipkan dari versi asli tanggal 2012-07-09. Diakses tanggal 2017-05-13.
- ^ a b Winter, Mark. "WebElements Periodic Table of the Elements | Caesium | biological information". WebElements. Diakses tanggal 13 January 2012.
- ^ Fieve, Ronald R.; Meltzer, Herbert L.; Taylor, Reginald M. (1971). "Rubidium chloride ingestion by volunteer subjects: Initial experience". Psychopharmacologia. 20 (4): 307–14. doi:10.1007/BF00403562. PMID 5561654.
- ^ Meltzer, H. L. (1991). "A pharmacokinetic analysis of long-term administration of rubidium chloride". Journal of clinical pharmacology. 31 (2): 179–84. doi:10.1002/j.1552-4604.1991.tb03704.x. PMID 2010564. Diarsipkan dari versi asli tanggal 2012-07-09. Diakses tanggal 2017-05-13.
- ^ Follis, Richard H., Jr. (1943). "Histological Effects in rats resulting from adding Rubidium or Cesium to a diet deficient in potassium". AJP: Legacy. 138 (2): 246. Diarsipkan dari versi asli tanggal 2012-07-11. Diakses tanggal 2017-05-13.
- ^ Gottschlich, Michele M. (2001). The Science and Practice of Nutrition Support: A Case-based Core Curriculum. Kendall Hunt. hlm. 98. ISBN 978-0-7872-7680-5. Diakses tanggal 9 July 2016.
- ^ Insel, Paul M.; Turner, R. Elaine; Ross, Don (2004). Nutrition. Jones & Bartlett Learning. hlm. 499. ISBN 978-0-7637-0765-1. Diakses tanggal 10 July 2016.
- ^ Melnikov, P.; Zanoni, L. Z. (June 2010). "Clinical effects of cesium intake". Biological trace element research. 135 (1–3): 1–9. doi:10.1007/s12011-009-8486-7. PMID 19655100.
- ^ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). "Cesium in mammals: Acute toxicity, organ changes and tissue accumulation". Journal of Environmental Science and Health, Part A. 16 (5): 549– 567. doi:10.1080/10934528109375003.
- ^ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). "Cesium in mammals: Acute toxicity, organ changes and tissue accumulation". Journal of Environmental Science and Health, Part A. 16 (5): 549– 567. doi:10.1080/10934528109375003.
- ^ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). "Acute toxicity of cesium and rubidium compounds". Toxicology and Applied Pharmacology. 32 (2): 239–245. doi:10.1016/0041-008X(75)90216-1. PMID 1154391.
- ^ Sartori H. E. (1984). "Cesium therapy in cancer patients". Pharmacol Biochem Behav. 21 (Suppl 1): 11–13. doi:10.1016/0091-3057(84)90154-0. PMID 6522427.
- ^ Wood, Leonie (20 November 2010), "'Cured' cancer patients died, court told", The Sydney Morning Herald
- ^ Price, Andy (December 20, 2004), "Francium", www.andyscouse.com, diakses tanggal February 19, 2012
Bacaan lebih lanjut
[sunting | sunting sumber]- Bauer, Brent A., Robert Houlihan, Michael J. Ackerman, Katya Johnson, and Himeshkumar Vyas (2006). "Acquired Long QT Syndrome Secondary to Cesium Chloride Supplement". Journal of Alternative and Complementary Medicine. 12 (10): 1011–1014. doi:10.1089/acm.2006.12.1011. PMID 17212573.
- Campbell, Linda M., Aaron T. Fisk, Xianowa Wang, Gunter Kock, and Derek C. Muir (2005). "Evidence for Biomagnification of Rubidium in Freshwater and Marine Food Webs". Canadian Journal of Fisheries and Aquatic Sciences. 62 (5): 1161–1167. doi:10.1139/f05-027.
- Chang, Cheng-Hung, and Tian Y. Tsong (2005). "Stochastic Resonance of Na, K-Ion Pumps on the Red Cell Membrane". AIP Conference Proceedings: 18th International Conference on Noise and Fluctuations. 780. American Institute of Physics. hlm. 587–590. doi:10.1063/1.2036821. ISBN 0-7354-0267-1.
- Erermis, Serpil, Muge Tamar, Hatice Karasoy, Tezan Bildik, Eyup S. Ercan, and Ahmet Gockay (1997). "Double-Blind Randomised Trial of Modest Salt Restriction in Older People". Lancet. 350 (9081): 850–854. doi:10.1016/S0140-6736(97)02264-2. PMID 9310603.
- Joffe, Russell T., Stephen T. Sokolov and Anthony J. Levitt (2006). "Lithium and Triiodothyronine Augmentation of Antidepressants". Canadian Journal of Psychiatry. 51 (12): 791–3. PMID 17168254.
- Krachler, M, and E Rossipal (1999). "Trace Elements Transfer From Mother to the Newborn – Investigations on Triplets of Colostrum, Maternal and Umbilical Sera". European Journal of Clinical Nutrition. 53 (6): 486–494. doi:10.1038/sj.ejcn.1600781. PMID 10403586.
- Stein, Benjamin P., Stephen G. Benka, Phillip F. Schewe, and Bertram Schwarzhild (1996). "Physics Update". Physics Today. 49 (6): 9. Bibcode:1996PhT....49f...9S. doi:10.1063/1.2807642.
Pranala luar
[sunting | sunting sumber]- (Inggris) "Group 1: The Alkali Metals". Visual Elements. Royal Society of Chemistry. Diakses tanggal 8 December 2009.
- (Inggris) Atomic and Physical Properties of the Group 1 Elements Sebuah pandangan mendalam tentang logam alkali
- (Inggris) Alkali Metal Bangs Reaksi lima gram sampel logam alkali dengan air (film)
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||











